Blog original en inglés por Merve Doğangün
Traducio por Nicholas Soden
Si usted es como yo, es posible que ya le espere en el sótano un montón de equipo electrónico con el cual no ha determinado qué hacer. No lo ha echado en la basura porque sabe que es una buena idea mantenerlo fuera de los vertederos…pero ¿por qué será? Los investigadores saben desde hace tiempo que si se filtran en los vertederos y desde allí en el suelo y las aguas subterráneas, los metales pesados contenidos en este equipo pueden presentar riesgos para la salud humana o el medio ambiente.1,2 Sin embargo, el uso de nanomateriales en baterías es mucho más nuevo, por lo tanto es muy importante entender lo que ocurre cuando encuentran una posible salida de las baterías, llegan a un vertedero y finalmente entran en contacto con las membranas celulares de los organismos en el medio ambiente.

Algunos carros eléctricos utilizan las baterías compuestas de nanomateriales de óxido de litio-cobalto (imagen de Avda)
Para ayudar a contestar la cuestión de lo que ocurre cuando estos nanomateriales entran en contacto con el medio ambiente, publicamos recientemente un estudio titulado “Alteration of Membrane Compositional Asymmetry by LiCoO2 Nanosheets.”3 En este proyecto, nos enfocamos principalmente en el óxido de litio-cobalto de tamaño nano (LiCoO2), que es una de las formas más sencillas de los cátodos que componen el extremo positivo (+) de la batería. Las baterías que utilizan este material son un ejemplo de lo que se suelen llamar las baterías de litio-ión.
El LiCoO2 está formado por nanoláminas que miden unos 45 nanómetros de largo. Nuestro gran objetivo aquí era determinar si estas nanoláminas constituyeran una amenaza para los organismos celulares. Pero, de hecho, el acto de simplemente verter un montón de LiCoO2 en una cuba que contiene algunas células bacterianas no nos ayudaría, pues no sólo queríamos saber si el material es dañino, sino también por qué o por qué no. Para controlar algunas de las variables implicadas en el experimento, utilizamos modelos idealizados de membranas celulares en vez de células reales. Como ya hemos discutido en el blog (en inglés), los científicos llevan un buen rato utilizando las bicapas lipídicas sobre sólidos soportes como modelos de membranas. Ya que la bicapa lipídica es el principal componente de las membranas celulares, un modelo así nos puede ayudar a identificar las bases de la interacción entre las nanoláminas y las células que investigamos en este proyecto.
Según lo que discutió Ian en esta publicación más reciente de su blog (en inglés), las partículas que se adhieren a la membrana pueden causar problemas a la célula. Por lo tanto, nuestro primer paso fue obtener imágenes de un microscopio electrónico que mostraron si las nanoláminas se adhirieran a la bicapa lipídica. Para que esto se llevara a cabo, creamos un modelo de una bicapa lipídica y la expusimos a las nanoláminas de LiCoO2 en una solución (mezclada uniformemente en un líquido). Luego, enjuagamos la bicapa con una solución libre de nanoláminas para que cualquier nanolámina que no se había adherido a la bicapa fuera arrasada. Las imágenes del microscopio mostraron que, incluso después de enjuagar la bicapa, las nanoláminas permanecieron adheridas a ella. Sin embargo, estas imágenes no nos dieron una idea de por qué se adhirieron.

¡Así se parecen nuestras nanoláminas de LiCoO2 bajo el microscopio electrónico de barrido!
Consideramos unos escenarios para explicar cómo puede cambiar la estructura de las bicapas lipídicas al interactuar con los nanomateriales. Recuerde que las bicapas lipídicas no son rígidas. Con las nanoláminas adheridas a ella, la bicapa puede volverse curva, más fluida o en cada capa puede haber cambios en la composición lipídica.5-7 Pero, ¿cuál es el escenario que explica el cambio y qué podría causar la interacción?
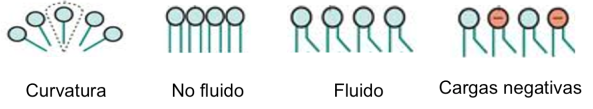
Las bicapas lipídicas tienen estructuras dinámicas — el embalaje de los lípidos en cada capa puede transformarse de diversas maneras. (En esta imagen sólo aparece la mitad superior de la bicapa.) (Se obtuvo la adaptación de la imagen con autorización de Nature Publishing8)
En busca de una respuesta, utilizamos una técnica llamada la espectroscopia de la suma de frecuencias (Sum Frequency Generation Spectroscopy: SFG). La SFG utiliza láseres ultrarrápidos para examinar las moléculas que se encuentran en la superficie de una sustancia. Basado en las investigaciones anteriores, nosotros sabíamos que las electrostáticas (con cargas positivas y negativas) desempeñan un gran papel en la manera en que las nanopartículas interactúan con las membranas celulares, así que investigamos las cargas implicadas en el sistema que estudiamos. Determinamos que en una solución por sí solas, las nanoláminas de LiCoO2 tienen cargas superficiales positivas. Desde allí, variamos la composición de la bicapa lipídica con diferentes cargas para ver si ésta cambiara la interacción entre la bicapa y las nanoláminas con carga positiva. La información que aprendimos nos ayudó a entender más claramente la interacción entre las nanoláminas y las bicapas lipídicas.
Como usted recordará de sus clases de física en el colegio, las cargas opuestas se atraen y las del mismo signo se repelen en la esfera de la electricidad estática. Esta ley que se remonta al siglo 18 nos ayudó a deducir que las nanoláminas con carga positiva atraía los lípidos con carga negativa, la cual producía asimetría en la membrana. En otros términos, los lípidos con carga más negativa son acercados a las nanoláminas, el cual causa diferencia de la composición lipídica de la mitad superior de la bicapa frente a la inferior.

Los lípidos con carga negativa son acercados a las nanoláminas con carga positiva, el cual produce asimetría en la bicapa. (Se obtuvo la adaptación de la imagen con autorización de ACS Nano3)
¿Qué significan los resultados que obtuvimos de las membranas modelos para las células reales? En los organismos multicelulares, se observa un cambio natural en la asimetría lipídica cuando llegue el momento en que la célula muera. Los macrófagos (también llamados “aspiradoras”) interpretan la asimetría como una señal que hay que eliminar las células. Esto se llama la muerte celular programada, un proceso esencial para el desarrollo del organismo. De hecho, ésta es la única forma en que funcionan bien las células restantes. Sin embargo, si la misma señal es desencadenada por un nanomaterial, los macrófagos no podrán diferenciar entre la muerte celular programada y las células con las nanopartículas adheridas a sus membranas – es posible que éstos eliminen la célula que se encontró con el nanomaterial, incluso cuando realmente no es el momento en que la célula va a morir.
Recuerde que nuestros hallazgos aquí se basan en membranas idealizadas que se ven en un modelo. Estos sistemas simplificados nos ayudan a entender mejor las posibles consecuencias biológicas de introducir grandes cantidades de estos materiales en el ambiente. Aunque de esto no podemos concluir que las nanoláminas matan las células, este estudio de las membranas modelos sugiere que las nanoláminas poseen el potencial de ser dañinas dentro de las células reales. Actualmente estamos trabajando juntos con otros laboratorios con el objetivo de ampliar estas investigaciones hasta los sistemas vivos. Los siguientes pasos consistirán en desarrollar los estudios de modelos como los nuestros para empezar a investigar los efectos que tienen los nanomateriales que se utilizan en las baterías de litio-ión sobre los sistemas vivos más complejos.
Se usan ampliamente las baterías de litio-ión para proveer energía para los móviles inteligentes, portátiles y algunos vehículos eléctricos. Basado en las investigaciones que he descrito aquí, espero que le haya convencido de que vale la pena pensar bien antes de echar en la basura estos aparatos almacenadores de energía. Al guardarlas para su reciclaje, usted puede ayudar a evitar todo posibles impactos ambientales adversos.
Este artículo forma parte de nuestro conjunto continuo de resúmenes útiles al público que describen los artículos de investigación que han sido publicados por miembros del Centro de la Tecnología Sostenible (Center for Sustainable Nanotechnology). Merve Doğangün, estudiante de doctorado de la Universidad Northwestern, fue el primer autor del artículo y colaboró en el estudio con investigadores del CSN en la Universidad de Wisconsin en Madison. Se publicó el artículo por primera vez en línea en Agosto de 2015 en la revista ACS Nano.3
RECURSOS EDUCATIVOS (En inglés)
- The Recycling Rates of Smartphone Metals
- understanding macrophages: “Acting Out the Immune Response: An Activity for the Middle School Life Science Classroom“
REFERENCIAS (hay algunas que requieren una subscripción para tener acceso al artículo completo)
- Robinson, B. H. E-waste: An assessment of global production and environmental impacts. Sci. Total Environ. 2009, 408, 183-191. doi: 10.1016/j.scitotenv.2009.09.044
- Jensen, D.; Ledin, A.; Christensen, T. Speciation of heavy metals in landfill-leachate polluted groundwater.
Water Research. 1999, 33(11), 2642-2650. doi: 10.1016/S0043-1354(98)00486-2 - Doğangün, M.; Hang, M. N.; Troiano, J. M.; McGeachy, A. C.; Melby, E. S.; Pedersen, J. A.; Hamers, R. J.; Geiger, F. M. Alteration of Membrane Compositional Asymmetry by LiCoO2 Nanosheets. ACS Nano. 2015 9 (9), 8755-8765. doi: 10.1021/acsnano.5b01440
- Edmonds, Molly. “What is apoptosis?” 31 March 2010. HowStuffWorks.com. Retrieved 24 September 2015.
- Munteanu, B.; Harb, F.; Rieu, J. P.; Berthier, Y.; Tinland, B.; Trunfio-Sfarghiu, A. M. Charged Particles Interacting with a Mixed Supported Lipid Bilayer as a Biomimetic Pulmonary Surfactant. Eur. Phys. J. E 2014, 37. doi: 10.1140/epje/i2014-14072-7
- Grillo, D.; de la Cruz, M. O.; Szleifer, I. Theoretical Studies of the Phase Behavior of Dppc Bilayers in the Presence of Macroions. Soft Matter 2011, 7, 4672-4679. doi: 10.1039/C1SM05061C
- Brown, K. L.; Conboy, J. C. Electrostatic Induction of Lipid Asymmetry. J. Am. Chem. Soc. 2011, 133, 8794-8797. doi: 10.1021/ja201177k
- Holthuis, J. C., & Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature, 2014, 510(7503), 48-57. doi: 10.1038/nature13474