Blog original en inglés por Nicholas Niemuth
Traducido por Scott Miller
En el Centro de la Nanotecnología Sostenible, a nosotros nos gusta estudiar y comprender las cosas pequeñas. Todo el mundo sabe el modismo, “no hay dos copos de nieve iguales,” pero ¿cómo se ha creado esta variación de forma al nivel molecular? Mientras experimentamos el fin de unos meses nevosos aquí en el Medio Oeste de los EEUU, parece apropiado investigar a fondo la ciencia de la nieve y cómo el copo de nieve clásico se forma.

Un bello copo de nieve. (imagen de Libbrect, (2005)1)
La mayoría de personas han tenido algunas experiencias divertidas y/o frustrantes con la nieve (quizás batallas con bolas de nieve o un carro atascado). Pero, ¿qué es la nieve? Los copos de nieve son cristales; específicamente, son cristales de agua. Cuando la temperatura desciende por debajo del punto de congelación, una situación puede resultar donde hay más vapor de agua en el aire que el aire puede contener (este fenómeno se llama “supersaturación.”) Para entender la supersaturación de agua en el aire, imagine cómo el agua se condensa en un vaso fresco en el tiempo húmedo, pero no se condensa en el tiempo seco. Para muchos cocineros, la supersaturación es un fenómeno familiar: ¡es importante al hacer el caramelo de dulce de leche!

¡Caramelo de dulce de leche! (imagen de Veganbaking.net)
Hacer el caramelo de dulce de leche supone el tratar de apiñar más azúcar en el caramelo de dulce de leche que puede contener. Como usted tal vez ya sepa de una experiencia (fracasada) pasada, mientras el caramelo de dulce de leche se refresca, a veces se puede arruinar por la cristalización del azúcar, dejándolo algo crujiente. Particularmente, este puede pasar si un cristal de azúcar no se disuelve en el proceso inicial de mezclar porque puede servir de núcleo de cristalización para el resto del azúcar.

(imagen con permiso de SnowCrystals.com)
La formación de los cristales de nieve en el aire funciona por un principio similar en cual las moléculas de agua se pegan a polvo en el aire y se ordenan espontáneamente en estructuras pequeñas de cristales. De este núcleo de cristalización, crecen los copos de nieve.
En la nieve, la fuerza por puentes de hidrógeno (un tipo de adherencia molecular que permite los enlaces reversibles entre las moléculas de agua) resulta en la formación de un cristal de seis lados (hexagonal). Desde aquí, el cristal crece a convertirse en prisma plano hexagonal, similar a una señal de pare, pero con seis lado en vez de ocho, como se puede ver en la imagen a continuación.
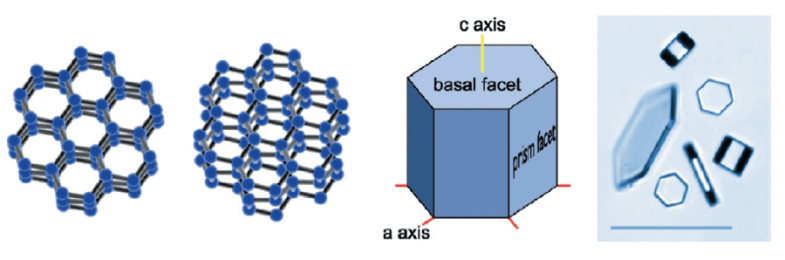
Las dos imágenes a la izquierda muestran cómo la geometría de moléculas de agua causa que se ordenen y se apilen en un adorno hexagonal como mostrado a la izquierda. Esto significa que los copos de nieve comienzan como cristales de nieve planos con seis lados, como el esquema y la foto a la derecha. (imagen de Libbrecht (2005)1)
El copo de nieve crece cuando más moléculas de agua pegan a la superficie del cristal. El modo en que las moléculas de agua se fijan depende de tres cosas:
- La adherencia de la superficie
- La energía de las moléculas de agua a la superficie, y
- La densidad de las moléculas de agua en el aire envolvente.
La adherencia de la superficie del cristal depende en su aspereza, y habrá más lugares en que se pueden adjuntar nuevas moléculas de agua en una superficie más rugosa. Por eso, una superficie más rugosa es más “adhesiva” que una superficie perfectamente lisa. En cuanto a la nieve, la aspereza de la superficie aumenta con temperaturas más tibias porque el proceso de deshelarse permite el movimiento de moléculas por la superficie. Este movimiento provee más sitios potenciales para atrapar nuevas moléculas de agua del aire. (Imagine que se agita un brazo: es más probable encontrar así una mano para agarrar que si se quedara el brazo en un solo lugar.)

Similarmente a las moléculas de agua en movimiento, cuando se agita las manos, es más probable que vayan a encontrar algo que puedan agarrar que si estuvieran quietas. (imagen de dominio público)
A la misma vez, para que las nuevas moléculas de agua se adhieran a la superficie del cristal, es necesario que el puente de hidrógeno entre la molécula y el cristal tenga más energía que la que la molécula tiene por la temperatura del aire envolvente. Una temperatura más alta resulta en moléculas que se mueven más rápidamente y con más energía por el aire y también en una probabilidad menor de que ellas se adhieran para aumentar el cristal. Este es análogo a coger una pelota: es más difícil cuando se la tira rápidamente (energía alta) que cuando se la tira lentamente (energía baja).
Por el otro lado, es más probable que las moléculas de agua en movimiento vayan a chocarse entre sí y, por eso, tener la oportunidad de adherirse. (Por ejemplo, ¡es más probable que los carros chocones vayan a chocarse con ellos si se mueven!) El crecimiento del cristal es un equilibrio delicado de las moléculas de agua moviéndose suficientemente lentamente para adherirse y suficientemente rápidamente para chocar con cristales a una velocidad bastante rápida.

(imagen con permiso de SnowCrystals.com)
Sobre todo, la probabilidad de que las moléculas se adhieran al cristal depende de la cantidad de las moléculas de agua en el aire envolvente (la supersaturación). Si hay más moléculas, hay una probabilidad más alta de que una molécula se adhiera al cristal, aumentándolo.
¡Guau! Claro, la superficie de un cristal de nieve es un lugar muy dinámico, con moléculas de agua pegando y despegando de la superficie en un malabarismo que varía con la temperatura y la supersaturación. Todavía, dadas las condiciones correctas, ¡las moléculas de agua se adherirán y el cristal comenzará a crecer!
Ahora, sabemos la razón por qué un cristal de nieve crece, pero ¿cómo es que un cristal de una forma de una señal de pare hexagonal, supuestamente simple, se transforma en los copos intricados famosos de la Navidad?

(imagen con permiso de SnowCrystals.com)
Aunque los bordes de la lámina que va creciendo en forma hexagonal parecen planos y uniformes (como los bordes de una señal de pare), un cristal de nieve no crece en la misma manera en todas las direcciones debido a algunas diferencias a lo largo de la superficie de los bordes. Las esquinas de la lámina proyectan más en el aire envolvente, y por eso hay más moléculas de agua en las seis esquinas que en el centro de los bordes. Como resultado, los bordes supuestamente simples de la lámina hexagonal crecen más rápidamente en las esquinas. Conforme avance el tiempo, el ritmo de adherencia a las esquinas seguirá superando lo a los centro hasta que las esquinas comiencen a proyectar. Esto es lo que causa (en las condiciones apropiadas) la formación del copo de nieve icónico con seis brazos. La imagen a continuación muestra este proceso.

Mientras un cristal de nieve crece, sus esquinas crecen más rápidamente que sus bordes, hasta que las esquinas proyecten como se puede ver en esta serie de imágenes de la izquierda a la derecha (imagen de Libbrecht (2005)1)
Una vez que las esquinas del cristal han crecido de la faz, las puntas que proyectan en el aire pueden funcionar como anclas para la adherencia rápida de moléculas de agua y el crecimiento con el aspecto de agujas de los seis brazos. Mientras los brazos crecen, cada brazo se convierte en una punta de adherencia para otras agujas, y la ramificación puede ocurrir, lo que forma un copo de nieve icónico con el aspecto de ramas de un árbol. (Vea un ejemplo en primer plano a continuación.)

Una vez que las esquinas proyectan como un ancla, la adherencia rápida de moléculas de agua puede llevar a crecimiento similar a los árboles, dando los “brazos” a un copo de nieve. (imagen de Libbrecht (2005)1)
Dado que las seis faces del copo de nieve experimentan las mismas condiciones, cada faz crece y desarrolla de maneras similares, y subsecuentemente el copo de nieve acaba simétrico. De la misma manera, a causa del hecho que su origen en las nubes y su camino al suelo tienen condiciones diferentes, el desarrollo de cada copo de nieve será un poco o drásticamente diferente, con el resultado de una forma “única” para cada copo. (Esto es similar a unos hermanos, con características similares y tal vez que crecieron en la misma casa, pero ¡todos resultan diferentes!)
Debido a las complexidades de adherencia, algunos cristales de nieve no resultan en propios copos. Algunos pueden permanecer platos o acaban como columnas o agujas, como se puede ver en la figura a continuación.
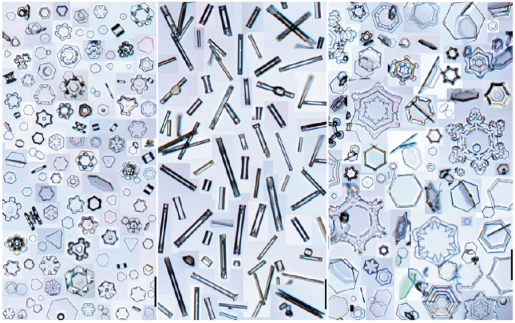
¡No es que toda la nieve resulte en copos, como se puede ver aquí! (imagen de Libbrecht (2005)1)
¡Ahí está, la ciencia de la nieve! De un pequeño cristal a una partícula de polvo a los copos bellos con seis brazos que todo el mundo conoce. (Échale un vistazo al video increíble aquí para ver el proceso desde el comienzo al final.)
Si tiene la fortuna de vivir en un lugar con nieve en este punto en el año, tome el consejo del autor que escribió el análisis que usé en esta entrada de blog (también en Viernes de Ciencia y en su buen sitio de web, snowcrystals.com), y vaya afuera durante la próxima nevada con una lupa (o un microscopio si lo tiene) e investigue las muchas formas diferentes de la nieve.

Algunas de las muchas formas diferentes de cristales de nieve. (imagen con permiso de SnowCrystals.com)
RECURSOS INFORMATIVOS (en inglés)
- El sitio de web de Dr. Libbrecht, SnowCrystals.com, incluye muchos imágenes más que las que nosotros han mostrado aquí, otros enlaces y recursos, y una página con actividades para los niños.
- Más allá de los pingüinos y los osos polares: crecer los flotadores y contraer bajadores (versiones para los niños de 5 a 11 años de edad). Incluye una actividad de modelar las moléculas con gominolas los palillos.
- Una actividad de ScienceKids sobre crecer cristales de “nieve” con bórax.
- ¿Quiere leer más entradas de Nano Sostenible sobre los cristales? Pruebe ¿Por qué el helado viejo acaba crujiente? (aquí en español) o Los metales nano-cristalinos y la sostenibilidad.
1) Libbrecht, K. The physics of snow crystals. Reports on Progress in Physics, 2005, 68 (4), 855-895. doi: 10.1088/0034-4885/68/4/R03