Blog original en ingles por Gene Chong
Traducido por Joel Hernandez
Editado por Becky Rodriguez
¡El Centro de Nanotecnología Sostenible le desea un feliz Día del Mol! Ésta es nuestra tercera publicación anual para el Día del Mol (vea las publicaciones de 2014 y 2015), así que ahora ha empezado a convertirse en una tradición. En esta publicación, le muestro un ejemplo de un verdadero cálculo escrito en papel que involucra moles, al cual realizo a veces en mi trabajo como químico teórico y computacional. Este cálculo nos ayudará a contestar la siguiente pregunta: ¿Cuántas moléculas de agua debo poner en una caja que mide 70 Å por 70 Å por 70 Å que contiene una nanopartícula de oro que mide 4 nanómetros?
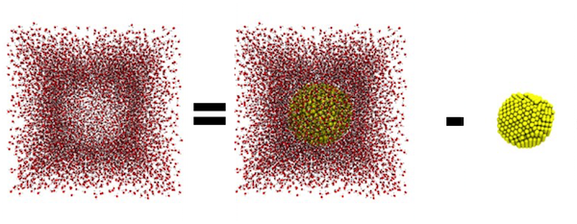
En una publicación anterior, Cathy Murphy calculó que una nanopartícula de oro de 4 nanómetros contiene ~2.000 átomos de oro. Para ser exacto, la partícula de 4 nanómetros a la izquierda contiene 2.123 átomos. ¡Siga leyendo para descubrir cuántas moléculas de agua hay en las imágenes en el centro y a la derecha! (Imagen por Gene Chong)
Para recordarle brevemente, el mol es una unidad SI (Sistema Internacional) que sirve para contar el número de átomos o moléculas de una sustancia (es parecido al minuto y como se usa para calcular cuántos segundos han transcurrido). Un mol de cualquier elemento de la tabla periódica contiene 6.022 x (también conocido como el número de Avogadro) átomos. En la química, se usa esta unidad con tanta frecuencia que los químicos la conmemoran el día 23 de octubre desde las 6:02 AM hasta las 6:02 PM.
¿Por qué no se celebra el Día del Mol el 2 de junio desde las 10:23 AM hasta las 10:23 PM? Me supongo que sería porque ya habría terminado el año escolar. Recuerdo que cada año mi profesor de química de la preparatoria celebraba y hacía concursos, tales como quién podía hacer el mejor dibujo del topo (“mole” en inglés) y realizando cálculos químicos para entusiasmarnos con la química. A mayor escala, durante la semana en que se celebra el Día del Mol, la Sociedad Estadounidense de Química (American Chemical Society) la considera la Semana Nacional de la Química (este año se celebró la semana pasada ya que se conmemoró el Día del Mol el domingo). La organización nombra un tema diferente cada año y les brinda actividades y recursos educativos a los estudiantes para que se involucren más en la materia. Los temas recientes abarcan “Nanotecnología: La gran idea más pequeña en la ciencia”, “La parte dulce de la química: los dulces”, y el tema de este año: “Resolver misterios a través de la química”. Haga clic en los enlaces para las actividades sugeridas para el aula, tales como crear un mensaje secreto usando tinta que desaparece y aparece, y determinar cuáles productos del jugo de fruta contienen colorantes alimentarios artificiales.

¡Un topo! (“Mole” en inglés, pero no el tipo que se usa en la química). (Imagen por Kenneth Catania).
Volviendo al tema de los moles: los experimentos en el aula generalmente se realizan en vasos de precipitados; es decir, en volúmenes grandes. Sería tonto hablar de cuántos miles de trillones de moléculas de los que esten en esos vasos de precipitados. En lugar de eso, las unidades típicas para la concentración que se usa en tales experimentos serían moles por litro. Para los químicos computacionales que tratan de entender cómo se comportan los átomos y las moléculas, la tecnología actual nos permite acceder a hasta unos pocos miles de procesadores informáticos que pueden trabajar colectivamente para modelar unos pocos millones de átomos a lo sumo. ¡Pero recuerde que un mol de átomos significa 6.022 x 1023 átomos! Eso quiere decir que soy incapaz de modelar o moles de material o litros (o incluso mililitros) de agua, ¡y así obviamente no puedo modelar la combinación de los dos! En una simulación, cada átomo necesita ser etiquetado y rastreado; por lo tanto, una unidad común de concentración para modelar es el número de átomos o moléculas por angstrom cúbico, o Å3. (Note que 1 m = 1010 Å y 1 cm3 = 1 mL). Sin embargo, aunque nuestro volumen es muy pequeño, todavía necesitamos asegurarnos de que coincida con la densidad de agua (1000 kg/m3 o 1 g/cm3). Después de todo, queremos simular la realidad.
Entonces, el volumen de mi caja de simulación es 343.000 Å3. ¡Eso mide 3.43 x 10-22 litros! ¿Podría imaginar dividir una botella de 2 litros de soda entre 68.600.000.000.000.000.000.000 personas? Al usar la fórmula para el volumen de una esfera, sabemos que el volumen de la nanopartícula esférica de 4 nm mide 4/3 x π x (20 Å)3. Por lo tanto, el volumen disponible para el agua es el volumen de la caja de simulación menos el volumen de la nanopartícula.

Para determinar el volumen del agua que está en la caja de simulación, tomamos el volumen total de la caja menos el volumen de la nanopartícula esférica. (Imagen por Gene Chong)
Ahora, para aquellos que sólo quieren saber la respuesta a la pregunta principal, multiplique la densidad de agua por el volumen de agua que acabamos de determinar para encontrar la masa del agua. Desde allí, para convertir la masa de agua en moles de agua, divídala por la masa molar de agua (la masa que sabemos contiene un mol de moléculas de agua). Finalmente, multiplique por el número de Avogadro para conseguir el número de moléculas de agua para colocar en la caja de la simulación. Así se ve en su totalidad:
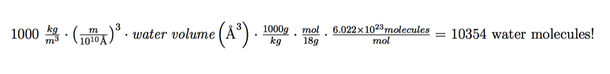
*Volumen de agua, moléculas, ¡moléculas de agua!
Así que la respuesta es que si quiero simular una nanopartícula de oro que mide 4 nm en agua dentro de una caja de 70 Å x 70 Å x 70 Å en la densidad correcta, tendré que añadir 10.354 moléculas de agua a mi modelo computarizado.
Esta es una versión simplificada de lo que hago. Ahora, supongamos que cubro la superficie de las nanopartículas con algunas moléculas locas que actúan como parches de velcro, y quiero saber cómo estas nuevas nanopartículas «decoradas» se pegan en solución. Luego, elegiría un tamaño de caja suficientemente grande para caber estas partículas y seguiría el mismo cálculo para calcular cuántas moléculas de agua debería de añadir. Y, por último, ¡ejecuto la simulación para predecir lo que podría suceder cuando la gente realmente las haga!
RECURSOS EDUCATIVOS
- La Sociedad Estadounidense de Química: actividades y recursos para el día del mol en la preparatoria
- La Sociedad Estadounidense de Profesores de Química: recursos para el día del mol
- Una publicación de Nano Sostenible sobre las unidades SI: ¿Cuándo es un kilogramo no un kilogramo?