Blog original en inglés por Cathy Murphy
Editado por Becky Rodriguez
Publicado orginialmente: 18 de febrero 2014
Todo está formado por átomos. Por lo general, los átomos están conectados firmemente los unos a otros, en una increíble variedad de configuraciones. Sin embargo, los átomos son tan pequeños que, ¿cómo es posible que conozcamos la estructura de la materia a nivel atómico?
Probablemente, usted ha visto imágenes de moléculas o materiales, con acercamientos a nivel atómico, en los que aparecen esferas de diferentes colores conectadas por líneas.

Estructuras de cloruro de sodio (sal de mesa) y penicilina. (imagen adaptada de origen)
En imágenes como esta, las esferas de colores representan diferentes tipos de átomos o iones (los iones son átomos que han perdido o ganado algunos electrones), uno por cada color; y las líneas representan los enlaces químicos que mantienen juntos a los átomos.
Después de observar imágenes como esta, quizás se preguntaría ¿qué tan real es esto? ¿De verdad conocemos la posición tridimensional de los átomos en una sustancia sólida? Además, ¿importa la manera en que los átomos están conectados unos a otros?
Las conexiones del cristal
La respuesta a la primera pregunta es: ¡sí, esto es real! El método clásico para determinar cuál es la organización tridimensional de los átomos en una sustancia sólida requiere que se obtenga primero un cristal puro y perfecto de esa sustancia. Su tamaño debe ser aproximadamente de un milímetro cúbico; es decir, más o menos del tamaño de un pequeño grano de arena.

Pequeños cristales de sacarosa, muchos de los cuales parecen no tener ningún defecto. Sería interesante analizar el cristal rectangular pequeñito que se encuentra cerca de la esquina superior izquierda. (Origen de la imagen)
Las perfectas superficies planas de un cristal, conocidas como caras, en realidad reflejan la organización casi perfecta de los átomos que constituyen ese cristal. Estas caras de cristal planas indican que los átomos, millones y millones de ellos, están, de hecho, muy ordenados. Ese orden sistemático y regular es la clave que nos permite determinar la posición de los átomos en las sustancias sólidas. Ahora, ¿cómo lo hacemos exactamente?
La interferencia es la solución
Desde la década de los treinta, la respuesta a esto ha sido “a través de difracción”.
Si se transmite luz a través de una hendidura suficientemente pequeña, puede tener lugar el interesante fenómeno conocido como difracción. Si la hendidura es pequeña (aproximadamente del tamaño de una longitud de onda), entonces, conforme pasan, las ondas de luz se traslaparán o anularán entre sí (los científicos dirían que “interferirán constructiva y destructivamente entre sí”) y producirán un patrón de difracción del otro lado de la hendidura.

El patrón de difracción producido por el paso de un láser rojo a través de una cuadrícula de hendiduras diminutas. (Origen de la imagen)
Entonces, en el caso de nuestro cristal, necesitamos proyectar una luz que tenga ondas del tamaño de átomos, para que los átomos del cristal actúen como una serie de hendiduras y produzcan un complejo patrón de difracción. El átomo promedio tiene un diámetro de aproximadamente 0.1 nanómetros; la luz que tiene una longitud de onda de este tamaño se encuentra en la región de los rayos X del espectro electromagnético. Si usted cuenta con una fuente confiable de rayos X que proporcione una longitud de onda muy específica, y también dispone de un cristal en buen estado, puede obtener patrones de difracción muy claros. A esta técnica se le conoce como difracción de rayos X de un solo cristal.
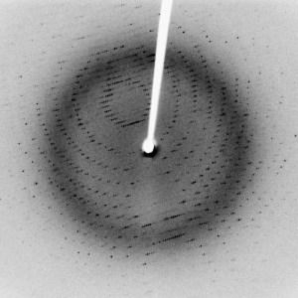
El patrón de difracción de rayos X producido por un solo cristal de proteína. (Origen de la imagen)
Para “determinar la estructura”, es necesario medir las posiciones e intensidades relativas de los puntos en el patrón de difracción, y recalcular la posición de los átomos. No incluiremos las operaciones necesarias aquí, pero básicamente se recurre al álgebra y a la trigonometría (¡no hace falta el cálculo!).
Los puntos más oscuros corresponden a los átomos más pesados (con cargas atómicas más pesadas) y los puntos más claros a átomos más ligeros. No es posible distinguir, sin embargo, un elemento de otro. Los átomos de carbono y los de nitrógeno, por ejemplo, son difíciles de distinguir unos de otros en la difracción de rayos X. Se necesitarían mediciones adicionales para confirmar qué elementos constituyen la sustancia sólida que se está analizando.
¿Por qué es importante la estructura atómica?
Ahora: ¿importa de alguna manera la manera en que están dispuestos los átomos en un sólido? La respuesta es ¡sí!
El mejor ejemplo de esto es el carbón. Sabemos que es uno de los elementos más importantes en nuestro planeta: pues todos los seres vivos lo contienen. Conocemos el carbón puro en forma de diamante, si está dispuesto de cierta forma en tres dimensiones, y como grafito, si está dispuesto de otra.
En un diamante, todos los átomos de carbón tienen enlaces químicos fuertes con otros cuatro átomos de carbón, y así forman tetraedros una y otra vez por todo el cristal.

Tanto los diamantes (izquierda) como el grafito (derecha) están constituidos por átomos de carbono, pero dispuestos de diferentes formas. (Origen de la imagen)
En el grafito, todos los átomos de carbono tienen enlaces químicos firmes hacia otros tres átomos de carbón, y forman así láminas que parecen malla de alambre; fuerzas débiles mantienen las láminas unidas en grupos que pueden deslizarse unos sobre otros con facilidad. Cuando escribimos con un lápiz sobre papel, son estas láminas las que se están deslizando y separando para dejar los trozos de grafito que marcan el papel.
Es evidente que las propiedades de los diamantes y el grafito son muy diferentes. El diamante es uno de los materiales más duros conocidos, es transparente a la luz y no conduce electricidad. El grafito es suave, gris y puede conducir bastante electricidad. ¡Es increíble que podamos observar propiedades tan distintas en dos sustancias que están compuestas de exactamente los mismos tipos de átomos! ¡Y todo se debe a la forma en que está dispuestos de los átomos! La capacidad de un sólido para existir en más de una configuración como esta se conoce como polimorfismo.
¡Y las propiedades polimórficas del carbón no terminan ahí! Entre los miembros de la comunidad nanotecnológica ha habido mucho interés respecto a los “nanocarbonos”. Los nanodiamantes son algo nuevo que estamos explorando en nuestro Centro. ¿Las propiedades de un nanodiamante serán como las que esperamos encontrar en su contraparte de mayor volumen y peso? ¿O nos llevaremos alguna sorpresa? ¡Seguiremos informándolos desde este blog!

Izquierda: una foto del polvo de nanodiamante que usamos en nuestros experimentos. Derecha: una imagen de nanodiamantes individuales agrupados, con una magnificación de ~1,000,000x, captados por un microscopio electrónico de transmisión.
El carbón puro también puede encontrarse en forma de moléculas que tienen números bien definidos de átomos. El premio Nobel de Química en 1996 fue otorgado a tres químicos que descubrieron las verdaderas formas moleculares del carbón: moléculas como C60 y otras cercanas, conocidas como fulerenos de buckyballs o “buckyesferas”. Los fulerenos tienen propiedades que, una vez más, son distintas de las de los diamantes o el grafito; por ejemplo, el C60 es morado y puede disolverse en fluidos aceitosos.
El hecho de que el carbono puro tenga tantas formas, con propiedades tan diferentes, explica por qué los químicos siguen dedicándose a la química. ¡Incluso los elementos puros de la tabla periódica siguen sorprendiéndonos!

2 comentarios sobre “La diferencia atómica entre los diamantes y el grafito”
Los comentarios están cerrados.