Blog original en inglés por Merve Doğangün
Publicado el 24 de Septiembre 2015
Traducio por Mariah Dooley, editado por Curtis Green
Si eres como yo, es posible que ya tengas un montón de aparatos electrónicos viejos en tu sótano, esperando a que descubras qué hacer con ellos. No los has sacado a la basura, porque sabes que es una buena idea mantenerlos fuera de los vertederos… ¿Pero por qué? Los investigadores han sabido por mucho tiempo que los metales pesados que se usan en las baterías de estos artículos podrían representar un riesgo para la salud humana o el medio ambiente si se desprenden de las baterías a los vertederos, y de allí al suelo y al agua subterránea.1,2 Sin embargo, el uso de nanomateriales en las baterías es algo más novedoso y, por lo tanto, es muy importante comprender lo que ocurre cuando estos nanomateriales potencialmente salen de las baterías, llegan a un vertedero y finalmente se encuentran con las membranas celulares de los organismos en el medioambiente.

Algunos autos eléctricos usan baterías con nanomateriales de óxido de cobalto de litio. (imagen de Avda)
Para ayudar a responder la pregunta de qué sucede cuando estos nanomateriales penetran en el medio ambiente, recientemente publicamos un documento llamado «Alteración de la Asimetría Composicional de la Membrana por LiCoO2Nanosheets”.3 En este proyecto, nos enfocamos principalmente en el óxido de cobalto de litio de tamaño nanométrico (LiCoO2), que es uno de los materiales de cátodo más simples que componen el extremo + de una batería. Las baterías que usan este material son un ejemplo de lo que generalmente se llama baterías de iones de litio (Li-ion).
LiCoO2 está formado por láminas de alrededor de 45 nm de longitud. Nuestro gran objetivo aquí fue determinar si estas nanoláminas constituyen una amenaza para los organismos celulares. Pero el solo hecho de tirar un montón de LiCoO2en un contenedor con algunas células bacterianas realmente no nos ayudaría, porque queríamos saber no solo si el material es nocivo, sino por qué (o por qué no). Para controlar algunas de las variables involucradas, utilizamos modelos idealizados de membrana celular en lugar de células reales. Como hemos discutido anteriormente en el blog, los científicos han estado utilizando bicapas lipídicas en soportes sólidos como membranas modelo durante bastante tiempo. Debido a que la bicapa lipídica es el componente principal de las membranas celulares, un modelo como este puede ayudarnos a identificar los fundamentos de la interacción de las células de las nanoláminas que estábamos estudiando en este proyecto.
Como Ian comentó en esta reciente publicación de blog, las partículas que se unen a la membrana pueden causar problemas para la célula. Entonces, nuestro primer paso fue obtener imágenes de un microscopio electrónico que mostraran si las nanoláminas estaban unidas a la bicapa lipídica. Para hacer esto, formamos una bicapa de lípidos modelo y expusimos la bicapa a las nanoláminas de LiCoO2en solución (mezcladas uniformemente en un líquido). Luego enjuagamos la bicapa con una solución libre de nanolámina para que cualquier nanolámina que no estuviera pegada a la bicapa se eliminara por lavado. Las imágenes del microscopio mostraron que las nanoláminas se adjuntaron a la bicapa incluso después del enjuague, pero estas imágenes no nos dieron una pista sobre por qué se unieron.

¡Aquí se muestra cómo se ven nuestras nanoláminas de LiCoO2bajo el microscopio electrónico de escaneo! (imagen de Merve Doğangün)
Hay algunos escenarios que consideramos para explicar: ¿cómo la estructura de las bicapas lipídicas puede cambiar cuando interactúan con los nanomateriales? Recuerda que las bicapas lipídicas no son rígidas. Con las nanoláminas adjuntas, la bicapa podría curvarse, podría volverse más fluida, o la composición lipídica en cada capa podría cambiar.5-7 ¿Pero qué escenario era y qué podría estar causando la interacción?

Las bicapas lipídicas tienen estructuras dinámicas: el relleno de lípidos en cada capa puede cambiar de varias maneras. (Solo se muestra la mitad superior de la bicapa en la imagen). (Imagen adaptada con permiso de Nature Publishing8)
En la búsqueda de una respuesta, usamos una técnica llamada espectroscopia de generación de frecuencia suma (SFG). SFG usa láseres ultrarrápidos para observar moléculas en la superficie de una sustancia. Basándonos en investigaciones pasadas, sabíamos que la electrostática (cargas positivas y negativas) juega un papel muy importante en la interacción de las nanopartículas con las membranas celulares, por lo que investigamos las cargas involucradas en el sistema que estábamos estudiando. Determinamos que las nanoláminas de LiCoO2 tienen cargas de superficie positivas solas en solución. Luego variamos la composición de la bicapa lipídica para tener diferentes cargas, así que pudimos ver si eso cambiaba la forma en que la bicapa interactuaba con las nanoláminas cargadas positivamente. Lo que aprendimos nos ayudó a entender la interacción entre nanoláminas y bicapas lipídicas mucho más claramente.
Como recordarás de tus clases de física de la escuela secundaria, en el mundo de la electricidad estática, las cargas opuestas se atraen y las cargas similares se repelen entre sí. Esta ley del siglo XVIII nos ayudó a descubrir que las nanoláminas cargadas positivamente atraían los lípidos cargadas negativamente, produciendo una asimetría en la membrana. En otras palabras, los lípidos cargados negativamente se acercarían más a las nanoláminas, haciendo que la composición lipídica sea diferente en la mitad superior frente a la mitad inferior de la bicapa.
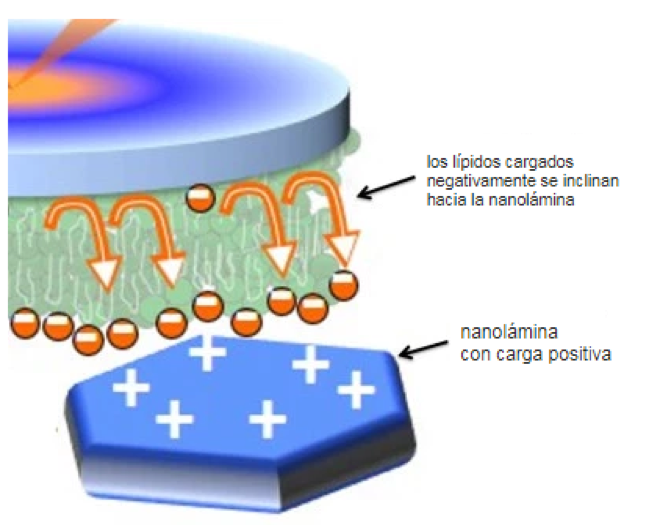
Las cabezas cargadas negativamente se tiran hacia las láminas cargadas positivamente, causando que la bicapa se vuelva asimétrica. (Imagen adaptada con permiso de ACS Nano 3)
¿Qué significan los resultados de las membranas modelo para las células reales? En organismos multicelulares, observamos un cambio natural en la asimetría de los lípidos cuando es hora de que muera una célula. Los macrófagos (los llamados «aspiradores»4) toman la asimetría como una señal para limpiar las células. Esto se llama muerte celular programada y es esencial para el desarrollo de un organismo. De hecho, esta es la única forma en que las células restantes funcionan bien. Sin embargo, si la misma señal pudiera ser disparada accidentalmente por un nanomaterial, los macrófagos no podrán distinguir la diferencia entre la muerte celular programada y las células con nanopartículas adheridas a sus membranas: podrían limpiar la célula que encontró el nanomaterial incluso si no es realmente el momento para que la célula muera.
Recuerda que nuestros hallazgos aquí se basan en membranas modelo idealizadas. Estos sistemas simplificados nos ayudan a comprender mejor las posibles consecuencias biológicas de la introducción de grandes escalas de estos materiales en el medio ambiente. Aunque no podemos concluir que LiCoO2 nanoláminas matan las células, este estudio de las membranas modelo sugiere que las nanoláminas pueden tener el potencial de ser nocivas en las células reales. Actualmente estamos trabajando junto con otros laboratorios para expandir esta investigación a sistemas vivos. Los próximos pasos de investigación serán construir sobre modelos de estudio como el nuestro para comenzar a investigar los efectos de los nanomateriales que se usan en las baterías de iones de litio en sistemas vivos más complejos.
Las baterías de ion de litio ya se usan ampliamente para cargar sus teléfonos inteligentes, computadoras portátiles y algunos autos eléctricos. Basado en la investigación que he descrito aquí, espero haberlo convencido de que vale la pena pensar dos veces antes de arrojar estas unidades de almacenamiento de energía a la basura. Al guardarlos para su reciclaje, puede ayudar a evitar cualquier posible impacto ambiental adverso.
Este post es parte de nuestra serie continua de resúmenes de divulgación pública que describen artículos de investigación que han sido publicados por miembros del Centro de Nanotecnología Sostenible. Merve Doğangün, estudiante de doctorado en la Universidad de Northwestern, fue el primer autor en este documento y colaboró en el estudio con investigadores de CSN en la Universidad de Wisconsin-Madison. El artículo se publicó por primera vez en línea en agosto de 2015 en la revista ACS Nano.3
RECURSOS EDUCATIVOS (en inglés)
- Compound Interest infographic: “The Recycling Rates of Smartphone Metals“
- Understanding macrophages: “Acting Out the Immune Response: An Activity for the Middle School Life Science Classroom“
REFERENCIAS (algunas requieren una suscripción para acceder el artículo completo)
- Robinson, B. H. E-waste: An assessment of global production and environmental impacts. Sci. Total Environ. 2009, 408, 183-191. doi: 10.1016/j.scitotenv.2009.09.044
- Jensen, D.; Ledin, A.; Christensen, T. Speciation of heavy metals in landfill-leachate polluted groundwater. Water Research. 1999, 33(11), 2642-2650. doi: 10.1016/S0043-1354(98)00486-2
- Doğangün, M.; Hang, M. N.; Troiano, J. M.; McGeachy, A. C.; Melby, E. S.; Pedersen, J. A.; Hamers, R. J.; Geiger, F. M. Alteration of Membrane Compositional Asymmetry by LiCoO2 Nanosheets. ACS Nano. 2015 9 (9), 8755-8765. doi: 10.1021/acsnano.5b01440
- Edmonds, Molly. “What is apoptosis?” 31 March 2010. HowStuffWorks.com. Retrieved 24 September 2015.
- Munteanu, B.; Harb, F.; Rieu, J. P.; Berthier, Y.; Tinland, B.; Trunfio-Sfarghiu, A. M. Charged Particles Interacting with a Mixed Supported Lipid Bilayer as a Biomimetic Pulmonary Surfactant. Eur. Phys. J. E 2014, 37. doi: 10.1140/epje/i2014-14072-7
- Grillo, D.; de la Cruz, M. O.; Szleifer, I. Theoretical Studies of the Phase Behavior of Dppc Bilayers in the Presence of Macroions. Soft Matter 2011, 7, 4672-4679. doi: 10.1039/C1SM05061C
- Brown, K. L.; Conboy, J. C. Electrostatic Induction of Lipid Asymmetry. J. Am. Chem. Soc. 2011, 133, 8794-8797. doi: 10.1021/ja201177k
- Holthuis, J. C., & Menon, A. K. Lipid landscapes and pipelines in membrane homeostasis. Nature, 2014, 510(7503), 48-57. doi: 10.1038/nature13474