Blog original en inglés por Cathy Murphy
Originalmente publicado 7 de Septiembre 2017
Traducio por Mariah Dooley, editado por Curtis Green
¿Alguna vez has hecho un rayo en un pepinillo? Yo sí. Implica poner dos clavos de hierro en un pepinillo y aplicar 110 voltios de electricidad. Es bastante apestoso, pero vale la pena ver lo que parece un rayo amarillo anaranjado en el pepinillo.
¿Qué es lo que sucede? El principio de «poner electricidad – salir de la luz» es fundamental para muchas tecnologías de visualización e iluminación, como los materiales de puntos cuánticos con los que trabajamos en el Centro de Nanotecnología Sostenible. Pero ¿cómo funciona? Usemos el pepinillo para descifrar este principio.
Primero, necesitamos decir algunas cosas sobre la luz. Usualmente pensamos en la luz como una onda, con cierta frecuencia y longitud de onda:

La relación entre la longitud de onda y la frecuencia (Imagen cortesía de MIT OpenCourseWare)
Hemos sabido por más de 100 años la relación entre estos parámetros para la luz:
c = λν
Donde c = la velocidad de la luz (3.00 x 108 m / s en el vacío), λ = la longitud de onda en metros, y ν = la frecuencia por segundo (medida en hercios).
Pero también podemos pensar en la luz como una partícula, un pequeño paquete de energía. Llamamos a este paquete un «fotón», como en «Dispara los torpedos de fotones, Sr. Sulu».

El Sr. Sulu conoce la importancia de la física y la química en la tecnología de torpedos (Imagen modificada de la estrella de Toronto)
También sabemos cómo relacionar la energía de un fotón con sus propiedades ondulatorias:
E = hν
Donde E es la energía del fotón (en Joules), h es una constante (constante de Planck, 6.626 x 10-34J s) y ν es frecuencia nuevamente (en unidades de «por segundo» o hercios, tal como lo vimos en la ecuación de onda).
Si lo piensas, es bastante sorprendente que podamos pensar en la luz como una partícula y como una onda al mismo tiempo. Esa conexión es un concepto importante en física y química.
Pero, ¿cómo se relaciona todo esto con el pepinillo? Bueno, podemos ver que la luz anaranjada sale del pepinillo cuando le ponemos energía en forma de electricidad. Si medimos la longitud de onda de esta luz usando un espectrómetro simple, encontraríamos que es 589 nm, or 589 x 10-9 m. Conociendo la longitud de onda, podemos calcular la energía de estos «fotones anaranjados”.
E = hν and c = λν
Entonces:
E = h(c/λ)
E = 6.626 x 10-34 J s (3.00 x 108 m/s ÷ 589 x 10-9 m)
E = 3.37 x 10-19 joules

Pepinos en vinagre (imagen de Photo-Mix)
Recordemos que un pepinillo comenzó su vida como un pepino y luego se remojó en soluciones de sal de mesa (cloruro de sodio) durante mucho tiempo como parte del proceso de decapado. Una pista de por qué la luz es naranja aquí: puedes experimentar remojando un pepinillo en otras sales, como cloruro de potasio o cloruro de estroncio, y cuando colocas 110 V a través del encurtido, ¡obtendrás otros colores de luz específicos! Por lo tanto, la luz naranja es particular para el sodio.
¿Cómo podemos entender esto? Experimentos similares se realizaron hace más de 100 años en vapor con muchos elementos diferentes, incluido el sodio; cuando se aplica voltaje a dos electrodos en los extremos de un tubo que contiene el vapor, el sodio también produce 589 nm de luz.

El vapor de sodio, con su longitud de onda de 589 nm, todavía se usa en alumbrado público (Imagen de Skatebiker)
Esto es lo que nosotros, la comunidad científica, finalmente descubrimos:
- Los átomos contienen electrones que rodean un núcleo. Los electrones son partículas que tienen una carga negativa y tienen una propiedad llamada «giro». (Representamos el giro escribiendo una flecha hacia arriba o una flecha hacia abajo para el electrón).
- Los electrones en un átomo no solo tienen energía aleatoria; existen en estados que tienen energías bien definidas.
- Llamamos a estos estados «orbitales» y tienen ciertas etiquetas como 1s o 2p (como se muestra en la figura a continuación, elemento 5). Además de tener una energía bien definida, cada orbital tiene una cierta forma tridimensional que corresponde a una ubicación donde podríamos encontrar el electrón. Sin embargo, no nos preocuparemos por las formas de los orbitales; solo necesitamos saber sobre las energías.
- Cuando ponemos energía en un átomo, promovemos electrones desde su estado de energía más bajo (el «estado fundamental») a un «estado excitado»:
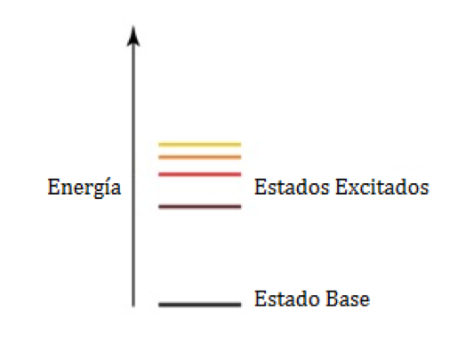
Los electrones en un átomo pueden aumentar en energía desde el estado fundamental a un estado excitado (Imagen de Rozzychan)
- Los electrones vuelven al estado fundamental al liberar energía en forma de un fotón de energía muy específica: 3,37 x 10-19 Joules en el caso del sodio:

Niveles de energía electrones de sodio orbitales
Estas ideas, que los electrones tienen energías específicas, se pueden promover a estados de mayor energía y luego relajarlos a su estado fundamental, a su vez son importantes para muchas aplicaciones que involucran electrones, lo que básicamente significa que todos los componentes electrónicos, computadoras, sensores, etc. pantallas, teléfonos celulares, etc. Si los electrones en un átomo NO tuvieran energías específicas, entonces veríamos un arco iris completo de colores saliendo de nuestro pepinillo electrocutado. Pero nosotros no: lo que vemos es naranja.
Y dado que estoy en la Universidad de Illinois, cuyos colores escolares son de color naranja y azul, todavía estoy buscando la mejor manera de obtener un pepinillo que emita tanto naranja como azul cuando le cargue con un voltaje.

El elusivo Pepinillo Illini… (Imagen modificada por Renee Comet)
RECURSOS EDUCATIVOS (en inglés)
- Alabama Learning Exchange: “Electron”-ic Battleship– a game of Battleship on the Periodic Table to review electron configuration of elements (grades 9-12)
- James Madison University: Electrocute a Pickle classroom demo lesson plan
REFERENCIAS
Appling, J. R.; Yonke, F. J.; Edgington, R. A.; Jacobs, S.; Jones, R. F. Sodium D Line Emission from Pickles.Journal of Chemical Education, 1993, 70, 250-251. doi: 10.1021/ed070p250
Rizzo, M. M.; Halmi, T. A.; Jircitano, A. J.; Kociolek, M. G.; Magraw, J. A.; Dozark, D. Revisiting the Electric Pickle Demonstration. Journal of Chemical Education, 2005, 82, 545-546. doi: 10.1021/ed082p545