Blog orignial en íngles por Bob Hamers
Editado por Becky Rodriguez
Originalmente publicado 13 Octubre 2016
A estas alturas ya habrás escuchado hablar del retiro del mercado de Samsung a todos los Galaxy Note 7. Hace varios años, todo un vuelo internacional, el 787 «Dreamliners», aterrezó debido a los incendios de baterías a bordo. Puede ser que usted se esté preguntando, «¿por qué todas estas baterías se enciendan? ¿Son seguras las baterías de iones de litio?”

¿Por qué los teléfonos celulares estallan en llamas?
Para responder a esto, vamos a ver cómo se hace una batería de iones de litio. La batería contiene cuatro partes principales: dos electrodos (cátodo positivo y ánodo negativo), el electrolito y un separador.

Los componentes básicos de una batería de iones de litio (imagen de Bob Hamers)
El electrodo positivo está hecho de un óxido metálico, generalmente LiCoO2 (óxido de litio cobalto), y el electrodo negativo está hecho de grafito. La idea básica de la batería es que tanto el LiCoO2 como el grafito son compuestos de una estructura en forma de lámina, lo cual permite que los iones de litio se deslicen entre las hojas. Para mantener fuera el aire y la humedad, los electrodos se sellan dentro de una bolsa de plástico, formando una «célula de bolsa».

Una célula de bolsa que protege los electrodos de la batería. Normalmente es plano – el aspecto hinchado se debe a un mal funcionamiento (Imagen adaptada de Mpt-matthew)
La siguiente figura muestra cuando se está recargando la batería: Cuando usted está cargando una batería, un voltaje externo de su cargador empuja los iones de Li fuera del cátodo LiCoO2; pasan por el electrolito y se deslizan entre las láminas del ánodo de grafito. Más tarde, cuando usa la batería, va dejando lentamente que los iones de litio vuelvan del grafito al LiCoO2, y para cada ion Li que regresa, un electrón se empuja a través del circuito externo para alimentar su laptop o teléfono celular. (Para aún más información acerca de cómo funcionan las baterías de iones de litio, visite a esta entrada del blog).
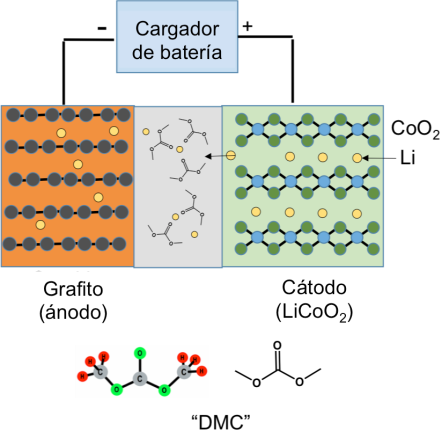
Un diagrama de la batería que muestra cómo los iones de litio pasan del cátodo de LiCoO2 a través del separador al ánodo de grafito (imagen de Bob Hamers)
El separador entre los electrodos es necesario porque hay una diferencia de voltaje entre el ánodo y el cátodo. Si se tocan, la batería tendrá un «cortocircuito» y un malfuncionamiento (ver más a continuación). Finalmente, el «electrolito» es un líquido orgánico que contiene un compuesto iónico llamado sal. El líquido orgánico consiste de una mezcla de compuestos que son derivados químicos de CO2. El diagrama anterior muestra una de estas moléculas en el área del separador gris, carbonato de dimetilo (“DMC” por sus siglas en inglés). DMC y carbonatos de alquilo relacionados son necesarios para transportar los iones Li entre los electrodos, pero DMC también es altamente inflamable. (Divulgación importante: en el 2007 cofundé una empresa, Silatronix, que está fabricando nuevos electrolitos no basados en carbonato para mejorar la seguridad y el rendimiento de las baterías, por lo que tengo un interés financiero y académico en la seguridad de las baterías).
Ahora que sabes cómo se supone que una batería funciona, volvamos a la presente pregunta: ¿Por qué las baterías de Samsung se incendian? Hay varias respuestas posibles, pero aquí están las tres más importantes:
1. Falla del separador
Como se mencionó anteriormente, si algo hace que el ánodo y el cátodo se toquen, entonces habrá un «cortocircuito». La batería se descargará rápidamente a través del área de contacto muy pequeña. Esa zona se calentará mucho, haciendo que el electrolito se rompa y se incendie. El fallo del separador puede ser causado por daños mecánicos y también puede resultar si usted deja la batería cargando todo el tiempo. Puede causar que el litio forme pequeñas «dendritas» similares a agujas que pueden perforar el separador.
2. Degradación del cátodo
El cátodo en la mayoría de las baterías se hace del LiCoO2. Existe una iniciativa para reemplazar esto con otros materiales, especialmente con óxidos mixtos como LiNiMnCo («NMC») o LiNiCoAl («NCA»), pero por ahora las baterías en la mayoría de nuestros electrónicos cotidianos como celulares y laptops casi seguramente contendrán LiCoO2. Cuando una batería está sobrecargada (cargada a un voltaje más alto del cual está diseñado), demasiados iones de litio son expulsados del LiCoO2. En estas condiciones, el LiCoO2 puede liberar oxígeno (O2) y transformar a un nuevo compuesto, Co3O4. Mientras que la mezcla de O2 con la mezcla de Co3O4 altamente inflamable es mala por sí sola, también es notable que Co3O4 es peor en la conducción de electricidad que el LiCoO2 original. Esto significa que cuando la batería es descargada y/o recargada la próxima vez, hay más calor dentro de la batería porque la resistencia del cátodo actúa como un pequeño elemento de calentamiento dentro de la batería. Si usted sigue intentando empujar los iones de Li hacia fuera, se pondrá lo suficientemente caliente para incendiarse. La sobrecarga puede ocurrir si utiliza el cargador de batería equivocada o si inadvertidamente cambia las baterías que están diseñadas para diferentes voltajes de funcionamiento.
3. Descomposición electrolítica y presurización celular
Los electrolitos consisten de moléculas que se derivan del dióxido de carbono. Cuando la batería está cargada, existe una posibilidad de desintegrar estas moléculas, liberando CO2. Aunque el CO2 es bastante inofensivo, recuerde que una batería de iones de litio está herméticamente cerrada, por lo cual CO2 presuriza la batería desde el interior, como una lata de soda que se deja en un coche caliente. Si algo causa que la batería se rompa, puede haber una liberación repentina del gas y del electrolito altamente inflamable.
Entonces, ¿son seguras las baterías de iones de litio? Para uso general, sí. Sin embargo, la presencia de compuesto inflamable en el interior siempre conduce a la posibilidad de un incendio. Es importante cuidar de sus baterías. Por ejemplo, siempre asegúrese de cargarlas a la tensión adecuada, y no cambiar entre cargadores diferentes. Es mejor no dejarlas en el cargador por más tiempo de lo necesario, ya que esto también reduce la duración de la batería. No deje su teléfono celular bajo el sol caliente, ya que las altas temperaturas generalmente aceleran las tasas de reacciones químicas, incluyendo aquellas que conducen a fallas en la batería y/o incendios de batería. Si la batería se está calentando, algo está mal y debe reemplazarla. Por último, ¡asegúrese de no poner nunca sus baterías de iones de litio en su equipaje documentado en un avión!
Porque no trabajo en Samsung, no puedo decir exactamente por qué el Galaxy Note 7 es particularmente propenso a la combustión. Probablemente tendremos que esperar un tiempo antes de que el veredicto final sea público, pero parece probable que haya un defecto en la fabricación o el diseño relacionado con uno o más de los tres tipos de fallas enumeradas anteriormente. En el caso de los famosos incendios 787 Dreamliner, la Junta Nacional de Seguridad de Transporte publicó un análisis que es información pública, pero no fue concluyente. Sin embargo, ese informe tiene muchas fotografías que muestran la construcción interna de baterías de formato más grande.
Lo más importante: Disfrute de sus electrónicos portátiles, pero recuerde que cualquier cosa que almacena energía – ya sea una batería en su teléfono celular o un tanque de gas en su coche – tiene el potencial para que la energía se libere de una manera imprevista. ¡Así que trate bien a sus baterías!
Robert Hamers es Director del Centro de Nanotecnología Sostenible. También es cofundador y director de ciencia de la nueva empresa Silatronix.
RECURSOS EDUCATIVOS (en íngles)
- Rechargeable Battery Recycling Corporation Battery Lesson Plan (grades 5+)
- Earth Day Canada: Battery Basics lesson plan (elementary)
RECURSOS ADICIONALES (en íngles)
- Battery University: información muy buena sobre la ciencia de la batería y la tecnología – http://batteryuniversity.com
- Scientific American: artículo sobre cómo las baterías conectaron a tierra el Boeing 787 Dreamliners – https://www.scientificamerican.com/article/how-lithium-ion-batteries-grounded-the-dreamliner/
- National Transportation Safety Board: análisis de los incendios de la batería 787 Dreamliner – http://www.ntsb.gov/investigations/AccidentReports/Reports/AIR1401.pdf
- Science Direct: Artículo técnico de código abierto sobre los mecanismos de fallo de la batería relacionados con los cátodos – http://www.sciencedirect.com/science/article/pii/S0921510714002657