Blog original en inglés por Cathy Murphy
Originalmente publicado 28 de Julio 2016
Traducio por Mariah Dooley, editado por Curtis Green
Hace dos años, escribí una publicación en el blog llamado Dos maneras de hacer Nanopartículas, que describe la diferencia entre los métodos descendentes y ascendentes para la fabricación de nanopartículas. En el post comenté “podemos estimar, sabiendo cómo los átomos de oro se acumulan en cristales, que hay alrededor de 2000 átomos de oro en una nanopartícula de oro de 4 nm de diámetro”. Recientemente, un lector de Nano Sostenible, escribió para preguntar ¿Cómo se hace este cálculo? ¡Es una gran pregunta!
Para estimar cuántos átomos hay en una nanopartícula de oro, tenemos que hablar un poco sobre la estructura cristalina. Los cristales se forman cuando los átomos (o moléculas) se organizan de forma ordenada en tres dimensiones. La unidad más pequeña de esa estructura se llama célula unitaria. En el ejemplo de abajo se muestra la estructura cúbica simple donde hay un átomo en cada esquina de un cubo, y los cubos se amontonan para formar la estructura cristalina.
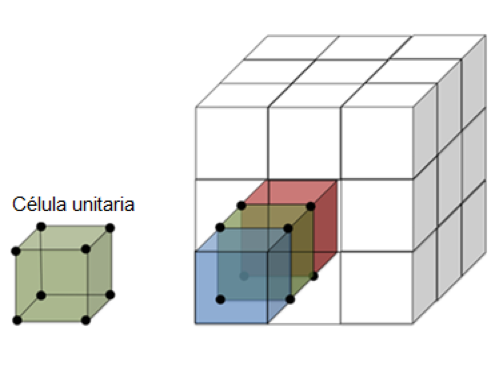
Un cristal cúbico simple construido a partir de 27 Células unitarias. (Imagen por Miriam Krause)
El oro se cristaliza en lo que se llama una estructura cúbica centrada en la cara. Esto significa que, además de los átomos de las esquinas en cada célula unitaria, como el ejemplo anterior, el oro también tiene un átomo en las caras de cada célula unitaria, uno para cada uno de los seis lados del cubo. Estos se muestran en verde en siguiente dibujo:

Una célula unitaria cúbica centrada en la cara. (Imagen de UC Davis ChemWiki)
Puede ser confundiente contar cuántos átomos hay en una célula unitaria de oro. Hay 8 átomos sentados en las esquinas de la célula unitaria, y 6 átomos que se sientan en cada cara de la célula unitaria. Pero debe imaginarse que esta célula unitaria está apilada encima de otras células unitarias, está debajo de otras, está al lado de otras y continúa así en todas las direcciones posibles.

Un cristal cúbico centrado en la cara con múltiples células unitarias amontonadas, con una célula unitaria en la esquina superior derecha. (Imagen de UC Davis ChemWiki)
¡Así que eso significa que los 8 átomos en las esquinas de cada unidad son compartidas por las unidades arriba, abajo y al lado! Resulta que cada unidad comparte sus átomos de esquina entre un total de 8 células unitarias, y esos átomos de cara verde también se comparten entre dos células unitarias adyacentes.
Por lo tanto, si queremos contar cuántos átomos hay en UNA célula unitaria de oro, solo debemos contar las piezas de los átomos que están en esa célula unitaria.
- Ya que cada átomo de esquina es solo 1/8 dentro de nuestra célula unitaria, pero hay 8 esquinas, 8 x (1/8) = 1.
- Dado que cada átomo de la cara está solo a la mitad dentro de nuestra célula unitaria, pero hay 6 de ellos, 6 x (1/2) = 3.
- 1 + 3 = 4, por lo que hay 4 átomos totales por célula unitaria.
¡Ahora estamos listos para pensar en nanopartículas!
Vamos a desempolvar algunas habilidades de geometría. Los experimentos de cristalografía de rayos X nos dicen que la longitud del borde de la célula unitaria para el oro es de 0,408 nanómetros. La célula unitaria es un cubo perfecto, por lo que su volumen (largo x ancho x alto) es 0.4083 = 0.0679 nm cúbico.

El volumen de un cubo = largo x ancho x alto, todos los cuales son 0.408 nm en este ejemplo.
A pesar de que las células unitarias de nanocristales de oro son cúbicas, las nanopartículas de oro tienen una forma bastante esférica. Si consideramos que una nanopartícula de oro de 4 nm de diámetro es una esfera con un radio de 2nm (recuerda que un radio = mitad de diámetro), entonces su volumen es 4/3 πr3 = 33.5 nm3.

El radio de una esfera es la distancia desde el borde al centro, 2nm en nuestra nanopartícula de oro de ejemplo; el volumen de la esfera = 4/3 πr3 (imagen adaptada de Darkdadaah)
Ahora que sabemos el volumen de las nanopartículas, tenemos que calcular cuántas células unitarias de oro ocuparán esa cantidad de espacio. Este cálculo es fácil: dividimos el volumen de la esfera por el volumen de la célula unitaria de oro: 33.5 / 0.0679 = 493 (aproximadamente).
Si queremos facilitar nuestras vidas, podemos redondear esto hasta 500 unidades de células por nanopartícula.
Ya sabemos que por la estructura cristalina del oro que hay 4 átomos por célula unitaria. Dado que hay alrededor de 500 células unitarias por nanopartícula, esto significa que tenemos alrededor de 4 átomos x 500 células unitarias = ¡2000 átomos de oro por nanopartícula!

Imágenes de Microscopía Electrónica de Transmisión (TEM) de nanopartículas de oro. (Imágenes de mi estudiante graduada Cassie Zhang)
RECURSOS EDUCATIVOS (en inglés)
- Sow, C. H., Udalagama, C. N. B., & Lim, G. Q. (2013). Teaching crystal structures using a transparent box with tennis balls. Journal of the NUS Teaching Academy, 3(1), 18-33.
- National Council of Teachers of Mathematics activity on dimensions & volume: Popcorn Anyone?
Gracias por el detalle