Blog Original en inglés por Joe Buchman
Originalmente publicado 13 de Abril 2018
Traducio por Mariah Dooley; Editado por Curtis Green
¿Alguna vez te has enfermado a causa de las bacterias?
Si respondes que no, no voy a creerte. Cuando la mayoría de nosotros pensamos en bacterias, recordamos lo miserable que fuimos la última vez que tuvimos una infección a la garganta u otra enfermedad bacteriana. Por supuesto, hay muchas otras cosas que pueden enfermar a las personas, pero en muchas situaciones las bacterias son las culpables. Por eso no a menudo no pensamos en todo lo bueno que las bacterias hacen por nosotros, como ayudar a la digestión de los alimentos y absorber sus nutrientes. Las bacterias también hacen mucho para mantener el medio ambiente.
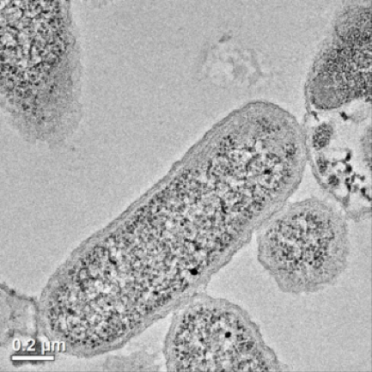
Figura 1. Las bacterias como S. oneidensis MR-1 (en la foto) rara vez enferman a las personas, pero cada día reciclan nutrientes en el medio ambiente para que sigan funcionando sin problemas. (Imagen de Joe Buchman)
Las bacterias tienen muchas funciones ambientales importantes, como convertir nutrientes en el suelo o el agua en una forma de que puedan ser utilizadas por otros organismos como las plantas. Debido a esto, las bacterias son buenos indicadores de la salud general de un ambiente: si las bacterias mueren, habrá menos nutrientes disponibles para los organismos superiores y ellos también morirán. Por esta razón los científicos usan bacterias en estudios ambientales. En el Centro de Nanotecnología Sostenible, estamos interesados en estudiar qué impacto pueden tener los nanomateriales que se usan en los productos cotidianos cuando se liberan en el medio ambiente. Por ejemplo, recientemente publiqué un artículo sobre experimentos hechos con ocho personas donde investigamos cómo reaccionó un panel de diversas bacterias cuando las expusimos a nanopartículas de oro con una particular especie de envoltura llamada clorhidrato de polialilámina o PAH (Figura 2).1
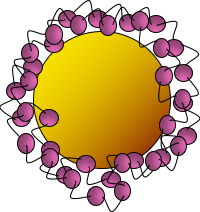
Figura 2. Una representación en caricatura de una nanopartícula de oro (círculo amarillo) que tiene PAH envuelto alrededor de su superficie (círculos rosados conectados por líneas negras). (Figura adaptada del Dr. Marco Torelli)
Sabemos que cuando las nanopartículas interactúan con las bacterias, a menudo se adhieren a la superficie bacteriana y en realidad no entran en el “cuerpo” de la bacteria. Pero solo la interacción con la superficie de la bacteria es suficiente para causar toxicidad. En trabajos previos en CSN se ha demostrado que en una clase de bacteria conocida como bacterias Gram-negativas, un tipo de molécula llamada lipopolisacáridos (LPS) ayuda a las nanopartículas a adherirse a la superficie bacteriana, como un tipo de velcro.
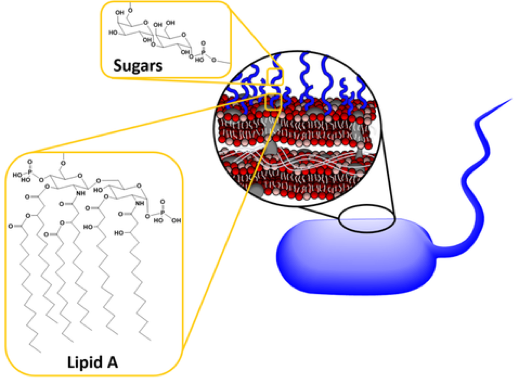
Figura 3. Las bacterias tienen paredes celulares que están cubiertas con una estructura llamada lipopolisacáridos (que se muestran aquí como garabatos azules). Estos lipopolisacáridos están formados por unidades de azúcar y lípidos (grasas). (Figura de Joe Buchman)
Las moléculas de LPS con aspecto de velcro cubren una gran parte de la superficie bacteriana y son importantes para las bacterias, ya que estabilizan su estructura y la protegen de los productos químicos nocivos. Como se muestra en la Figura 3 anterior, las moléculas LPS están formadas por una región de lípidos A que las ancla en la membrana y luego azúcares que se extienden hacia el área circundante. Ahora, cada especie de bacteria Gram-Negativa usa diferentes azúcares en su LPS, lo que significa que cada especie tiene una estructura de LPS única. Para agregar a esa variación, las bacterias también pueden tener diferentes longitudes de LPS. Las moléculas más cortas llamadas LPS rugosas tienen una región de lípido A y una región de azúcar central corta, pero las moléculas más llamadas LPS lisas tienen una región de lípido A, región de azúcar de núcleo corto y también una región de antígeno O, que es una cadena larga de azúcar repetida2 (Figura 4).
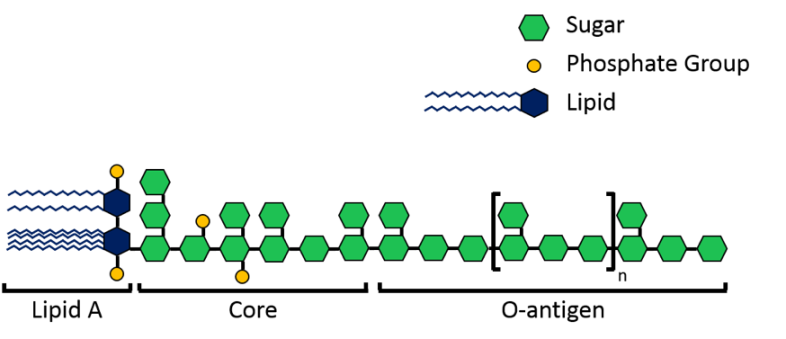
Figura 4. Una estructura general de LPS. El LPS rugoso tiene solo un lípido A y una región central, mientras que el LPS liso tiene una región de lípido A, núcleo y antígeno O. La región del antígeno O es una repetición larga de azúcares, con una unidad repetitiva de n longitud, donde n puede ser mayor que 50 repeticiones. “Sugar” (azúcar), “Phosphate Group” (grupo fosfato), “Lipid” (lípido), “Core” (núcleo), “O-antigen” (antígeno O) (Figura de Joe Buchman)
Dado que los LPS son un actor tan importante en la interacción de nanopartículas con baterías Gram-negativas, queríamos aprender más sobre la unión de nanopartículas de oro envueltas en PAH con moléculas de LPS en las bacterias. La forma en que lo hicimos fue realizar simulaciones por computadora que toman en cuenta todos los átomos del sistema entero de nanopartículas-membrana bacteriana, que se llama acertadamente “simulaciones de todo átomo”. Funcionan al tomar las diferentes propiedades para cada átomo único en cuenta en el cálculo de cómo se comportarán.
Una limitación para las simulaciones de todo átomo es cuántos átomos se pueden incluir, porque cuanto más se incluyen, más tiempo llevará una computadora hacer todos los cálculos necesarios. Si intentáramos modelar una nanopartícula de oro completa con una sola bacteria, ¡habría más de 83.000.000.000 de átomos en nuestra simulación!* Por lo tanto, creamos un sistema simplificado donde observamos cómo el grupo de superficie en las nanopartículas de oro, PAH interactuaba con una única molécula de LPS. Esto nos permite minimizar el número de átomos en la simulación (a poco más de 50,000), ¡y aun así cada simulación tardaba entre 65 y 75 horas en llevarse a cabo!
Lo que la primera simulación nos mostró es que la molécula PAH (átomos rosados en la imagen de abajo) migra a una parte particular de la estructura LPS: grupos fosfato (átomo marrón rodeado por cuatro átomos rojos). Esto nos dijo que el fosfato es importante para la interacción PAH-LPS (Fig. 5).
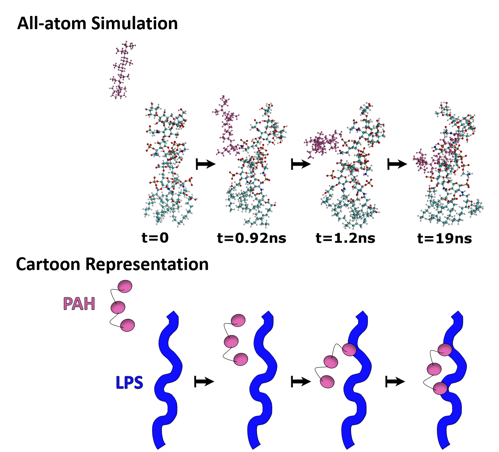
Figura 5. Esta simulación de todo-átomo es exactamente lo que su nombre implica: una simulación química que toma en cuenta todos los átomos. En la parte superior, puede ver todos los átomos representados como bolas de colores para una molécula de lipopolisacárido (azul / rojo) y de las nanopartículas de oro (rosa). La serie de imágenes muestra la ubicación del HAP en comparación con el LPS durante un período de tiempo (19 nanosegundos). Una representación de dibujos animados a continuación simplifica la interacción que vemos entre LPS y PAH. “All-atom Simulation” (simulación de todo-átomo), “Cartoon Representation” (representación de dibujos animados) (Imagen adaptada de Buchman et al.1 con permiso de la Sociedad Real de Química)
Mencioné antes que las nanopartículas se unen a la superficie bacteriana y exhiben sus efectos tóxicos allí, por lo cual es fácil suponer que una mayor unión correspondería a una mayor toxicidad. El siguiente paso en nuestro estudio fue pasar del modelado por computadora a un experimento de mesa para probar la relación entre la unión de nanopartículas y la toxicidad. Era importante observar las bacterias de diferentes entornos, ya que las nanopartículas pueden terminar en muchos comportamientos ambientales diferentes (suelo, agua dulce, agua salada, etc) y queríamos ver qué efecto tendrían las nanopartículas en cada uno de ellos. Por lo tanto, creamos un “panel” bacteriano que consiste en cinco bacterias de diferentes entornos que tienen funciones ambientales beneficiosas y únicas.
Lo primero que se debe hacer es observar la unión de las nanopartículas a la bacteria, lo cual es más fácil decirlo que hacerlo porque las nanopartículas son demasiado pequeñas para ser visibles con microscopios típicos (para más información sobre los límites de la microscopía, consulte esta publicación del blog). Hicimos esta parte del estudio al exponer las bacterias a nanopartículas de oro y luego analizarlas con dos métodos. El primer método fue la microscopía electrónica de transmisión (TEM), que nos permite ver visualmente la unión de nanopartículas (la Figura 6 muestra las imágenes TEM con una flecha roja para indicar un ejemplo de unión de nanopartículas para cada bacteria en el panel). También usamos una técnica que nos decía cuántas bacterias tenían nanopartículas de oro unidas a ellas.
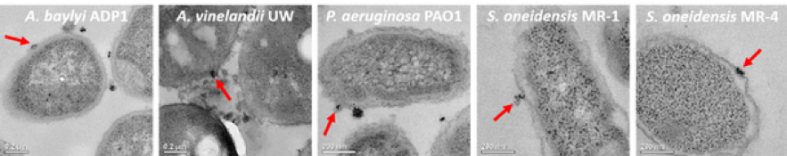
Figura 6. Las imágenes del microscopio electrónico de transmisión muestran ejemplos de unión a cada bacteria utilizada en nuestro estudio (las flechas rojas señalan una instancia de nanopartículas unidas a la superficie bacteriana). (Figura adaptada de Buchman et al.1 con permiso de la Sociedad Real de Química).
También determinamos la toxicidad de las nanopartículas de oro envueltas en PAH para cada bacteria. Esto se hizo determinando qué concentración de nanopartículas se requería para matar a la bacteria. Para realizar estos estudios, expusimos las bacterias a nanopartículas de oro en un rango de concentraciones (0, 0.0281, 0.281 y 2.81 partes por millón (ppm)). Después de la exposición, colocamos seis gotas de cada exposición bacteriana en placas ricas en nutrientes para que crezcan las bacterias supervivientes. Luego observamos qué concentraciones causaron la muerte de las bacterias. El crecimiento bacteriano aparece como círculos blanquecinos / amarillentos donde se colocó la gota, por lo que si no hay círculos, sabemos que la bacteria no creció (Fig. 7). (Esta técnica es similar a la técnica de «recuento de colonias» sobre la que escribí en esta publicación del blog).
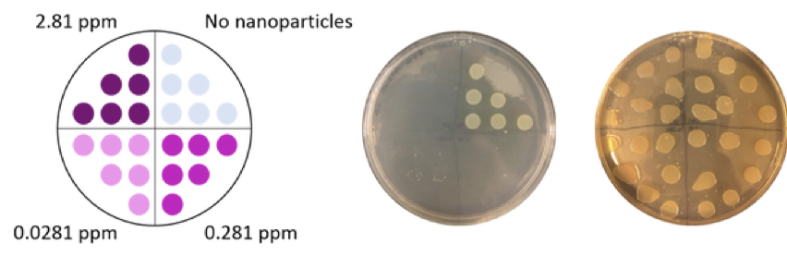
Figura 7. Ejemplos de determinación de la concentración bactericida mínima para cada bacteria. La imagen de la izquierda muestra dónde se colocaron las seis gotas de cada exposición (las concentraciones indicadas). La imagen del medio muestra un ejemplo en el que todas las concentraciones de nanopartículas de oro mataron a las bacterias (indicadas por el crecimiento bacteriano solo para la exposición sin nanopartículas). La imagen de la derecha muestra un ejemplo donde la bacteria sobrevivió a todas las concentraciones de exposición a nanopartículas de oro. “No nanoparticles” (sin nanopartículas)(Figura de Joe Buchman)
Con los datos de toxicidad recopilados, llegó el momento de comparar los datos de enlace que teníamos. Lo que encontramos en esta comparación no fue lo que esperábamos. Al observar nuestros datos, vimos casos en los que hubo una cantidad similar de toxicidad ligante pero muy diferente, o donde hubo toxicidades similares pero diferentes cantidades de unión. En general, no hubo correlación entre la cantidad de unión de nanopartículas y la toxicidad observada.
De esto se desprende que cuanto más tipos de bacterias se incluyen en un estudio, más complejidad biológica encontramos que contradice la simple relación de «más unión significa más toxicidad». La identificación de estas complejidades biológicas es importante para comprender la naturaleza completa de la interacción entre nanopartículas y bacterias. Aún no comprendemos por qué la unión de más nanopartículas no siempre significa más toxicidad para las bacterias, pero nuestro estudio demuestra la importancia de utilizar un panel bacteriano como el nuestro en lugar de una única especie bacteriana para cualquiera que desee realizar estudios de nanotoxicidad en el futuro. Hacer más estudios para comprender la complejidad de la interacción nano-bio debe ayudar a los científicos a predecir qué efectos tóxicos pueden tener las nanopartículas en diferentes organismos, lo que a su vez les permitirá diseñar nanopartículas que reduzcan el impacto ambiental.
NOTA
* Para esta estimación, calculé que los átomos en una bacteria eran 8.34×1010(usando la masa de una bacteria3 y su composición elemental4) y utilicé nuestra publicación del blog en español sobre cómo calcular cuántos átomos de oro hay en una nanopartícula de oro ( que, siendo alrededor de 2000 átomos, realmente no contribuye a la cantidad total de átomos en el sistema de bacterias y nanopartículas, ya que el número de átomos de oro era tan pequeño en relación con los átomos en una bacteria, los átomos en los ligandos de la nanopartícula superficie no se calcularon).
REFERENCIAS (en inglés)
- Joseph T. Buchman, Ali Rahnamoun, Kaitlin M. Landy, Xi Zhang, Ariane M. Vartanian, Lisa M. Jacob, Catherine Murphy, Rigoberto Hernandez and Christy Haynes. Using an environmentally-relevant panel of gram-negative bacteria to assess the toxicity of polyallylamine hydrochloride-wrapped gold nanoparticles, Environmental Science: Nano, 2018, 5 (2), 279-288. doi: 10.1039/C7EN00832E
- Wang, X.; Quinn, P.J. Endotoxins: Structure, Function, and Recognition. Springer: New York, NY. 2010.
- Davis, Dulbecco, Eisen, Ginsberg, Bacterial Physiology: Microbiology, Second Edition, Maryland: Harper and Row, 1973: 96-97.
- B10NUMB3R5, Empirical elemental formula for biomass (2017): http://bionumbers.hms.harvard.edu//bionumber.aspx?id=101800&ver=18