Blog original en inglés por Joe Bennett
Originalmente publicado 10 de Mayo 2018
Traducio por Mariah Dooley; Editado por Curtis Green
El desarrollo de la nanotecnología ha sido una ruta emocionante hacia la innovación química que ha cambiado la forma en que vivimos. Campos tan diversos como la medicina, el tratamiento del agua y el almacenamiento de energía han utilizado dispositivos a nanoescala y arquitecturas nanométricas para mejorar las tecnologías relacionadas con la salud humana, las comunicaciones y el transporte. La nanotecnología es un gran negocio y se estima que será aún mayor en las próximas décadas.
A medida que aumenta la cantidad de nanotecnología en nuestra vida diaria, también aumenta la necesidad de comprender el impacto ambiental potencial y el destino a largo plazo de los materiales a nanoescala que usamos. Un ejemplo inevitable es el desperdicio electrónico, también llamado desecho electrónico, de nuestros dispositivos móviles. Los materiales a nanoescala en electrónica pueden (en algunas circunstancias) transformarse, liberando metales pesados y materiales potencialmente tóxicos. Eso significa que si los desechos electrónicos no se eliminan adecuadamente al final de su vida útil/funcionamiento, una consecuencia podría ser la exposición involuntaria a estos metales pesados y otros materiales tóxicos. Esto podría representar un riesgo significativo para la salud humana y el medio ambiente a medida que aumenta la cantidad total de nanomateriales que utilizamos.

Figura 1. Desechos electrónicos (Imagen de CODIGO82)
Pero, ¿cómo funcionan estas transformaciones químicas? Mis colegas y yo recientemente publicamos un trabajo de investigación en el que usamos un método computacional llamado teoría de densidad funcional (DFT) para investigar cómo ciertos materiales se transforman si están expuestos al agua.1 Nuestro ejemplo específico fue un material de óxido de metal complejo llamado NMC: Li (Ni1/3Mn1/3Co 1/3) O2. Debido a que NMC (y materiales relacionados, como LiCoO2) son parte de las baterías que alimentan nuestros dispositivos móviles, se estima que serán un componente importante de los desechos electrónicos en el futuro. Usamos modelos computarizados para descubrir qué sucede con las superficies de los materiales de la batería cuando interactúan con el agua.
Encontramos que en el agua, el litio (Li) se disolverá fácilmente de la superficie del NMC, y que en esas condiciones la superficie del NMC preferiría estar cubierta con átomos de hidrógeno que toma del agua. Llamamos a esto una superficie hidratada, y usamos una combinación de modelado y termodinámica para mostrar que una vez que la superficie se hidrata, también permite que los otros metales se disuelvan del material.

Figura 2: Ejemplo de cómo puede disolverse la superficie de un material de batería. a) Los átomos de Li superficiales se disuelven primero; b) Los átomos de O subsuperficiales se disuelven a continuación; c) Los átomos metálicos interiores se disuelven al último. (Imagen de Joe Bennett)
¿Cómo utilizamos el modelado por computadora para resolver esto? Calculamos una propiedad llamada energía libre de disolución, combinando valores bien conocidos basados en experimentos con nuestras propias energías calculadas mediante el DFT. Una ilustración de ejemplo se muestra en la figura número 3 a continuación. Pudimos usar ecuaciones básicas (como ¡la ecuación de Nernst!) de la clase de química de la escuela secundaria para incluir efectos como cambios en el pH y la concentración. Encontramos que los metales tienden a disolverse fuera de NMC más fácilmente a un pH bajo (pH ácido de 3, como el vinagre) que a un pH neutro (pH 6-7, como el agua), y que la disolución depende en gran medida del número y la ubicación de diferentes metales en el material. Por ejemplo, era más probable que el manganeso se disolviera de la superficie de NMC cuando estaba en una concentración del 11% que una concentración del 17%. Esto también significa que las reacciones de disolución se detienen después de un tiempo, porque llega a un punto en el que se han eliminado demasiados metales, y no es favorable para eliminar nada más de la superficie del NMC.
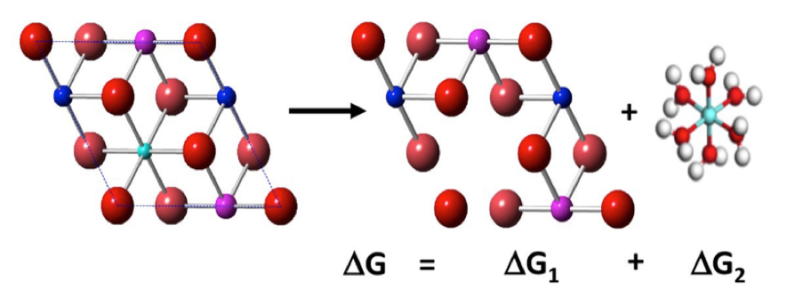
Figura 3: El cálculo de la energía libre de disolución de los materiales de la batería se puede dividir en dos partes. La primera pieza (ΔG1) se puede calcular con el DFT. Es un método computacional que necesita conocer la identidad y la ubicación de cada átomo en una estructura. La segunda pieza (ΔG2) se puede encontrar en los libros de texto y se puede ajustar de acuerdo con los cambios en los experimentos. (Imagen de Joe Bennett)
Diferentes metales en NMC también se disolvieron a diferentes velocidades. En general, descubrimos que el litio se disuelve primero, seguido por el níquel, el cobalto y el manganeso, que corresponde de forma cualitativa con los hallazgos de experimentos previos realizados por nuestros colegas del Centro de Nanotecnología Sostenible.
Nuestro trabajo de investigación es un importante paso adelante en la conexión de los cálculos DFT a las condiciones experimentales medibles por un par de razones. Primero, nos permite usar DFT para crear reglas para rediseñar los nanomateriales que son benignos por diseño. También proporciona información sobre las transformaciones a nanoescala de óxidos metálicos complejos, un área que es importante para comprender los impactos en la salud y seguridad ambiental. El trabajo futuro incluirá cómo el cambio en la composición de NMC afectará la disolución del metal. Por ejemplo, compararemos composiciones que son más ricas en manganeso con otras que son más ricas en níquel. Nuestra hipótesis es que la disolución del metal depende en gran medida de la identidad y el número de diferentes metales vecinos, y que diferentes cantidades de metales se disolverán a diferentes velocidades de diferentes composiciones. ¡Óxidos metálicos complejos de hecho!
REFERENCES
- Bennett, J. Jones, D., Huang, X., Hamers, R. & Mason, S. Dissolution of complex metal oxides from first-principles and thermodynamics: Cation removal from the (001) surface of Li(Ni1/3Mn1/3Co1/3)O2. Environmental Science & Technology, 2018, Available Online. Doi: 1021/acs.est.8b00054