Blog original en inglés por Meng Wu
Originalmente publicado 14 de Febrero 2018
Traducio por Mariah Dooley, Editado por Curtis Green
El oro es uno de los metales más deseados en el mundo. El precioso metal amarillo es raro en la naturaleza y ha sido usado como un medio de moneda y para la fabricación de joyas desde la antigüedad (Figura 1)1. Se cree que los meteoros lo trajeron a la tierra este metal, ¡el oro en verdad está fuera de este mundo!2 Hay muchas razones por las cuales el oro es especial y por qué ha mantenido su valor en nuestras sociedades. Pero el oro podría ser incluso más especial de lo que pensamos.

Figura 1: Una diadema de oro de la antigua Grecia (Siglo IV BCE). En el museo de arte de Dallas. (Imagen por Mary Harrsch)
Al fabricar y procesar este brillante metal, las personas han ido aprendiendo gradualmente sus propiedades físicas y químicas. “El verdadero oro no le teme al fuego,” es un antiguo dicho chino, que se origina a partir del hecho de que el oro a granel se mantiene intacto y brillante cuando se coloca sobre fuego de leña (600-1000 °C), mientras que la mayoría de otros metales (tales como cobre, zinc y níquel y sus aleaciones) se derretirían y/o perderían su brillo en esas condiciones. En términos químicos, decimos que el oro tiene excelente estabilidad química contra la oxidación y un punto de fusión relativamente elevado (1064 °C). Pero resulta que, gracias a la nanociencia, hay maneras de cambiar la forma en que el oro se comporta a diferentes temperaturas preservando sus otras características especiales.
Usemos nuestra experiencia diaria con el agua como ejemplo para ayudar a entender qué está pasando con el oro. Sabemos que el hielo (sólido) parece siempre derretirse en agua (líquido) a una temperatura fija, y luego parece que el agua parece siempre evaporarse a vapor (gas) a una temperatura fija. A estas temperaturas se les conoce como el punto de fusión y ebullición, respectivamente. Los puntos de fusión y ebullición pueden ser diferentes dependiente en la presión local. Esta es la razón por la que sus recetas de cocción u horneado pueden tener instrucciones diferentes para altitudes elevadas, que tiene una presión de aire más baja que las altitudes bajas.
Sin embargo, no tenemos que subir y bajar montañas para manipular el punto de ebullición. Fácilmente podemos hacer esto cambiando la presión local, como funciona una olla a presión: al aumentar la presión, el punto de ebullición del agua aumenta a una temperatura más elevada, lo que significa que el agua puede calentarse sin evaporarse, lo que a su vez hace que la comida se cocine más rápido (Figura 2).

Figura 2: Una olla a presión cambia el punto de ebullición de su contenido (Imagen de goodfreephotos.com).
Para entender cómo una olla a presión aumenta la presión en el interior, tenemos que recordar que sucede con las moléculas de un líquido cuando se calienta: ¡Comienzan a separarse más! Hasta el punto de fusión, sin embargo, es mucho menos sensible al cambio de presión local. Esto se debe a que, en comparación con el líquido que se evapora a gas, el volumen generalmente no aumenta demasiado cuando los sólidos se derriten y se convierten en líquidos. (Nota al margen: el agua es inusual en el sentido de que su volumen en realidad aumenta cuando se congela hasta convertirse en un sólido. – ¿Alguna vez ha explotado una lata de soda en el congelador? – ¡Pero ese es un tema para otra publicación!)
El punto principal es que no es práctico manipular el punto de fusión de una sustancia por cambiar la presión local. Tendrías que hacer un cambio drástico en la presión para obtener incluso un pequeño cambio en el punto de fusión (Figura 3).

Figura 3: El volumen cambia mucho al pasar de gas a líquido; no tanto cuando pasa de líquido a sólido. (Imagen por Yeled)
Pero ¿hay otras formas de alterar el punto de fusión de un material? Y volviendo al tema principal de esta publicación, ¿podemos fundir el oro a temperatura ambiente?
En una publicación anterior del blog, “Las Nanopartículas están a nuestro alrededor” (en inglés), discutimos que a medida que el tamaño de un material disminuye a nanoescala, muchas propiedades físicas y químicas también cambian. Esto se debe principalmente al “efecto de superficie”. O al aumento de la relación superficie- volumen (Figura 4)3.
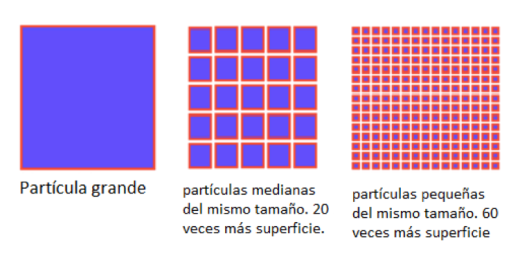
Figura 4: El poder de las nanopartículas: el área de superficie aumenta a medida que disminuye el tamaño de partícula. (Imagen de Bob Hamers)
El color del oro, por ejemplo, cambia de amarillo brillante a amarillo oscuro cuando su tamaño disminuye al rango nanométrico (Figura 5). Entonces, ¿cómo cambia el punto de fusión de un material a medida que su tamaño disminuye hasta la escala nanométrica?

Figura 5: Soluciones de nanopartículas de oro. Los colores de solución cambian a medida que aumenta el tamaño de las nanopartículas de oro. (Imagen de Aleksandar Kondinski)
Ya en 1871 (cuando no tenía ninguna forma de ver en realmente las nanopartículas), el señor William Thomson demostró que el punto de fusión cambia inversamente con el radio de una partícula de acuerdo con la siguiente ecuación, conocida hoy como la ecuación de Gibbs – Thomson4.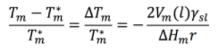 Si agregas información sobre el tamaño de la partícula y otras características del material, esta ecuación muestra que el tamaño y el punto de fusión del material están directamente relacionados. A medida que el tamaño del material disminuye, también disminuye el punto de fusión. Este fenómeno es comúnmente conocido como “depresión del punto de fusión”.5
Si agregas información sobre el tamaño de la partícula y otras características del material, esta ecuación muestra que el tamaño y el punto de fusión del material están directamente relacionados. A medida que el tamaño del material disminuye, también disminuye el punto de fusión. Este fenómeno es comúnmente conocido como “depresión del punto de fusión”.5
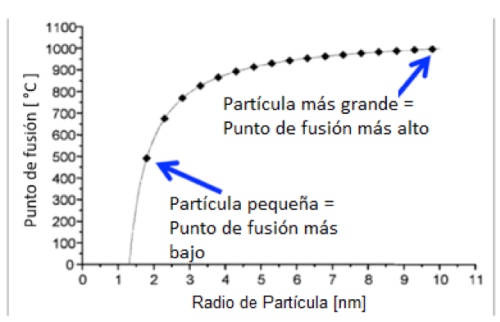
Figura 6: Relación entre el tamaño de partícula y el punto de fusión de las nanopartículas de oro. (Gráfico usado con permiso de Schmid & Corain (2003)6).
La figura 6 muestra la relación entre el tamaño de las nanopartículas y el punto de fusión del oro, de acuerdo a la ecuación de Gibbs-Thomson. Como podemos ver, el punto de fusión de las nanopartículas de oro puede ser incluso más bajo que la temperatura de ambiente (~23-25 °C) cuando el tamaño disminuye a menos de aproximadamente 1.4 nm. En ese tamaño, hay solo alrededor de 85 átomos presentes en cada nanopartícula, y la mayoría de los átomos están expuestos en la superficie6. (En contraste, en una partícula de 4 nm, hay cerca de 2000 átomos de oro, dejando aún más átomos dentro de la partícula. Te preguntarás, ¿cómo sabemos esto? Consulte, nuestra publicación en el blog, “¿Cómo se puede calcular cuántos átomos hay en una nanopartícula?” (en inglés).)
La diferencia entre un sólido y un líquido es fácil a observar para los objetos de tamaño normal: los líquidos se mueven, fluyen y toman la forma de los objetos que los contienen pero los sólidos son rígidos y no se deslizan7. Pero ¿existe una manera de visualizar directamente las “nanopartículas líquidas” que hemos estado describiendo?

Figura 7: a diferencia de las nanopartículas, es fácil a observar cuando los gatos tienen las propiedades de un líquido8 (imagen de Peregrino Will Reign)
La microscopía electrónica de transmisión (TEM) es muy adecuada para este propósito. Cuando el rayo de electrones golpea una muestra, puede calentar y fundir las nanopartículas. Los átomos en una muestra también pueden hacer que el rayo de electrones incidente difracte en muchas direcciones específicas. Midiendo los ángulos y las intensidades de estos rayos difractados, se pueden crear patrones de difracción y se puede determinar la posición de los átomos en la muestra. Los átomos generalmente están altamente ordenados en sólidos, pero se mueven en líquidos, lo que dará como resultado de diferentes patrones de difracción. Los patrones de manchas se observan generalmente para muestras sólidas, mientras que los patrones de halo se observan generalmente para muestras líquidas. A continuación, podemos diferenciar el estado sólido del estado líquido observando sus patrones de difracción de electrones. (Para obtener más información sobre microscopía electrónica, consulte nuestra publicación del blog en español “La naturaleza bajo el microscopio: La exploración de la belleza de la nanociencia”).

Figura 8: Patrón de difracción para estado líquido (Patrones de halo, izquierda) y estado sólido (patrones de manchas, derecha) de plomo. (Imagen reproducida con permiso de JPSJ, Takagi (1954)9)
Ya en 1954, Takagi usó por primera vez esta estrategia para probar “la supresión del punto de fusión” (Figura 8). Eligió el plomo para estudiar porque tiene un punto de fusión relativamente bajo y puede convertirse fácilmente en una capa de 5 nm de grosor. Bajo TEM, Takagi y su equipo observaron que el punto de fusión de una capa de 5nm de grosor disminuyó de los 327 °C a 170 °C habituales.9
Aunque los resultados de Takagi fueron impresionantes, no fueron capaces de capturar la transición de sólido a líquido en tiempo real. Hoy en día podemos hacer esto gracias al desarrollo de lo que se llama TEM in situ. Más interesante aún, recientemente un equipo de científicos de Ucrania y Bielorrusia descubrieron que incluso una nanopartícula de plata en estado sólido puede comportarse como un líquido.10 Cuando se colocaron las nanopartículas de plata de menos de 10nm en una punta de tungsteno, los investigadores observaron el comportamiento “líquido” bajo ciertas circunstancias. Las nanopartículas de plata se mantuvieron altamente cristalinas en el interior, lo que significa que no se derritieron – si las partículas se hubieran derretido, esperaríamos ver patrones cristalinos y una disposición atómica completamente aleatorizada (como el patrón de halo de la figura 8). Este interesante comportamiento “líquido” se atribuyó a los átomos de la nanopartícula de plata que se mueven bajo presión, dando una ilusión de que se derritió (Figura 9).

Figura 9: microscopía electrónica de transmisión de alta resolución in situ que muestra la deformación de tipo líquido de las nanopartículas de plata. (Imagen utilizada con permiso de Sun et al. (2014)11)
Todo esto nos ayuda a comprender que, aunque la gente solía pensar que “El verdadero oro no le teme al fuego”, ahora sabemos que los metales a nanoescala, incluyendo el oro, pueden comportarse como líquidos a temperatura de ambiente.
Por un lado, la depresión del punto de fusión significaría que algunas nanopartículas sean menos útiles si necesitan estar en un estado sólido para funcionar en sus aplicaciones tecnológicas. Por otro lado, la depresión del punto de fusión también es muy útil para las aplicaciones donde las nanopartículas funcionan mejor en estado líquido. Por ejemplo, podemos fácilmente cambiar la forma de los materiales a nanoescala a temperaturas mucho más bajas de lo que su punto de fusión sugeriría.
Por lo tanto, la respuesta a la pregunta con la comenzamos es: ¡Sí! De hecho, el oro o cualquier otro material, se puede considerar como “fundido/derretido” gracias a las propiedades increíbles de los materiales a nanoescala.
RECURSOS EDUCATIVOS (en inglés)
- The International Association for the Properties of Water and Steam: Why does water expand when it freezes?
- Journal of Chemical Education: The Science of Chocolate: Interactive Activities on Phase Transitions, Emulsification, and Nucleation by Amy Rowat et al. (may require subscription)
- University of Georgia Extension: The Science Behind our Food – Using Freezing-Point Depression to Find Molecular Weight
REFERENCIAS
- Krasimirov, A. The World’s Oldest Gold Artifact May Have Just Been Discovered.Huffington Post, Aug 10, 2016.
- Choi, C. Q. Asteroids May Have Brought Precious Metals To Earth.Live Science.com Sep 7, 2011.
- Mott, S. M. The Size Of Matter: Why Properties Change At The Nanoscale.Yale National Initiative.
- Thomson, W. On The Equilibrium Of Vapour At A Curved Surface Of Liquid.
The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science.1871, 42, 448. - Lu, H. M., et al. Size-, Shape-, And Dimensionality-Dependent Melting Temperatures Of Nanocrystals.Physical Chemistry C.2009, 113, 7598-7602.
- Schmid, G., Corain, B. Nanoparticulated Gold: Syntheses, Structures, Electronics, and Reactivities.Journal of Inorganic Chemistry. 2003, 17, 3081-3098.
- Yirka, B. Researchers Seeking To Redefine Difference Between Solids And Liquids.org, Apr 8, 2013.
- Fardin, M. Answering the question that won me the Ig Nobel prize: Are cats liquid? The Conversation, Nov 8, 2017.
- Takagi, M. Electron Diffraction Study of Liquid-Solid transition of Thin Metal Films.Journal of the Physical Society of Japan. 1954, 9, 359-363. DOI: 10.1143/JPSJ.9.359
- Yeshcheko, O. A., et al. Surface Plasmon As A Probe For Melting Of Silver Nanoparticles.Nanotechnology,2010, 21, 045203.
- Sun, J., et al. Liquid-like Pseudoelasticity Of Sub-10-nm Crystalline Silver Particles.Nature Materials. 2014, 13, 1007-1012.