Originalmente publicado en inglés
Publicado el 11 de junio del 2018
Traducido por Regina González Lona,
Editado por Wilanyi R. Alvarez Reyes y Lissett G. Diaz
¿Alguna vez has pensado en cómo serías sin un esqueleto?
Nuestros esqueletos nos dan nuestra estructura y también nos permiten movernos. Sin los huesos que forman nuestro esqueleto, seríamos una masa de tejidos que no podría moverse. De la misma manera, las células tienen algo llamado citoesqueleto que les da estructura y dirige su movimiento. A diferencia de los esqueletos humanos, las células también usan sus citoesqueletos como un sistema de transporte interno, transportando material de un lado a otro de la célula y en la división celular. Para hacer estas cosas, las células usan tres tipos de elementos del citoesqueleto: actina, microtúbulos y filamentos intermedios. La actina (roja en la Figura 1 a continuación) a menudo se encuentra a lo largo del exterior de la célula, mientras que los microtúbulos (verde) se pueden ver en toda la célula.

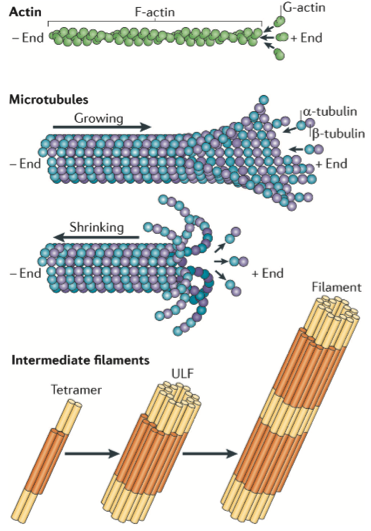
Si bien la composición proteica de estos tres componentes es diferente (mostrado en la Figura 2), lo que tienen en común es que todos son estructuras largas y delgadas. Debido a que las proteínas del citoesqueleto son tan diversas e importantes, muchos científicos quieren estudiarlas. Además, debido a que el citoesqueleto a menudo está involucrado en procesos dinámicos, los investigadores necesitan métodos de microscopía especiales para usar en estudios de imágenes. Un desafío es que los componentes del citoesqueleto son tan delgados que están por debajo del límite de difracción de la luz, lo que requiere el uso de técnicas de microscopía que nos acerquen o se encuentren por debajo de ese límite (consulte esta publicación anterior para obtener una explicación del límite de difracción de la luz) .
Hay muchas interacciones más allá del citoesqueleto, como las interacciones proteína-proteína, que los científicos están interesados en estudiar y que involucran características o especies por debajo del límite de difracción de la luz. Esto condujo al desarrollo de varias técnicas de microscopía llamadas microscopía de fluorescencia de superresolución, que nos permiten ver estructuras tan diminutas. Un ejemplo es la microscopía de reconstrucción óptica estocástica (STORM por sus siglas en inglés) que los investigadores del Centro de Nanotecnología Sostenible utilizaron para estudiar cómo las nanopartículas se unen a la superficie de las bacterias.2 Existen otras microscopías de súper resolución (ver ejemplos en publicaciones anteriores aquí y aquí), pero uno de los grandes beneficios de usar la microscopía de fluorescencia es que nos permite ver solo estructuras específicas o interacciones de interés dentro de una célula al agregar moléculas fluorescentes solo a esos componentes, lo que nos permite ignorar todo lo demás en la célula.
Teniendo en cuenta todos los diferentes tipos de microscopía de súper resolución, ¿cómo deberían los científicos elegir qué opción usar? En una revisión de la literatura que publiqué recientemente con varios coautores,3 comparamos diferentes tipos de microscopía de fluorescencia de resolución cercana y resolución superior y discutimos cómo se ha utilizado cada uno para estudiar el citoesqueleto. Al decidir sobre una técnica, es importante considerar la cuestión científica que queremos investigar. Primero, debido a que los procesos biológicos que involucran al citoesqueleto son dinámicos, queremos capturar los cambios a lo largo del tiempo. Sin embargo, no siempre es tan sencillo: con el citoesqueleto a veces tenemos que elegir entre ver muy claramente las interacciones entre estructuras (alta resolución espacial) o ver las interacciones que se están produciendo muy rápidamente (alta resolución temporal). Para diferenciar entre resolución espacial y temporal, imagina un guepardo. Si estuviéramos interesados en las manchas de un guepardo, querríamos una imagen de alta resolución espacial para mostrar todos los detalles de las manchas. Si estuviéramos interesados en la mecánica de cómo corren, querríamos una serie de imágenes tomadas en una sucesión muy rápida. Probablemente no podríamos usar la misma cámara para obtener ambos tipos de imágenes.
Afortunadamente, con diferentes tipos de microscopía de fluorescencia de alta resolución, podemos elegir la técnica que mejor se adapte a la pregunta que estamos tratando de responder. Si nuestras preguntas están más relacionadas con la estructura celular, entonces los científicos pueden trabajar con células fijas, células que han sido tratadas con ciertos químicos para «congelarlas» en su orientación en el momento de interés. En ese caso, los investigadores deberían elegir técnicas de alta resolución que tomen más tiempo para adquirir imágenes pero que lo hagan con más detalle. Por otro lado, si las preguntas científicas están relacionadas con interacciones muy rápidas entre partes de la célula, los investigadores deberían usar técnicas que recopilen datos rápidamente pero a expensas de los detalles finos.
Nuestra revisión de imágenes para el citoesqueleto cubre dos técnicas de microscopía de fluorescencia de resolución cercana (confocal y TIRF) y tres técnicas de microscopía de súper resolución (PALM, STORM y STED).
- La microscopía confocal y TIRF (o fluorescencia de reflexión interna total) brinda imágenes muy detalladas de regiones específicas de una célula. Usando microscopía confocal, los científicos pueden obtener imágenes de «rebanadas» de células y es adecuado para imágenes no dinámicas de filamentos de actina (rojo en la figura 1 y la hebra más delgada en la figura 2).
- Con la microscopía TIRF, se pueden obtener imágenes de las interacciones que ocurren cerca de la membrana celular. Se ha utilizado para estudiar el papel del citoesqueleto en los procesos celulares, por ejemplo, cómo funciona una respuesta inmunitaria, qué proteínas u otras moléculas se secretan de una célula y cómo se mueve una célula.
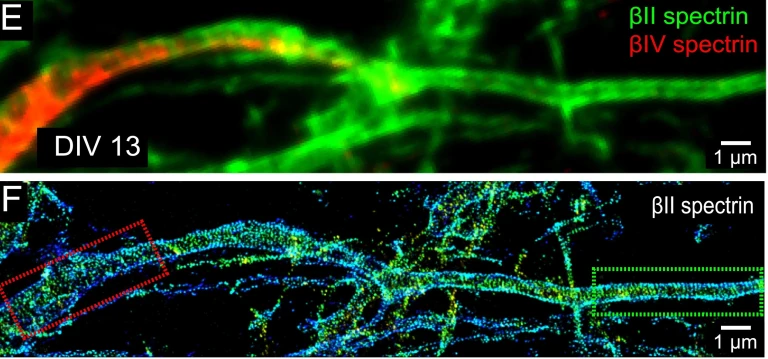
- PALM y STORM funcionan tomando una serie de imágenes donde las sondas fluorescentes se “encienden y apagan” repetidamente y luego la serie de imágenes se combina para crear una imagen muy detallada. Puede ver algunas imágenes geniales tomadas con STORM en la Figura 3 a continuación.
- Por otro lado, STED utiliza un sistema de dos láseres para crear una pequeña área fluorescente para imágenes específicas.
Estas técnicas de superresolución permiten a los científicos comprender mejor cómo se ensamblan y regulan los filamentos del citoesqueleto. La revisión que escribimos analiza los pros y los contras de cada técnica para varias preguntas científicas, ¡e incluso hacemos sugerencias de experimentos que los científicos pueden hacer para llenar los vacíos de conocimiento en el campo! Con el gran conjunto de herramientas disponible, los científicos seguirán mejorando nuestra comprensión del citoesqueleto y las muchas funciones que desempeña en el soporte de las células.
Referencias
- Mostowy, S. & Cossart, P. Septins: the fourth component of the cytoskeleton, Nature Reviews Molecular Cell Biology, 2012, 13, 183– 194. doi: 10.1038/nrm3284
- Jacobson, K., Gunsolus, I., Kuech, T.; Troiano, J., Melby, E., Lohse, S., Hu, D., Chrisler, W., Murphy, C., Orr, G., Geiger, F., Haynes, C., & Pedersen, J. Lipopolysaccharide density and structure governs the extent and distance of nanoparticle interaction with actual and model bacterial outer membranes. Environmental Science & Technology, 2015, 49 (17), 10642–10650 doi: 10.1021/acs.est.5b01841
- Finkenstaedt-Quinn, S., Qiu, T., Shin, K., & Haynes, C. Super-resolution imaging for monitoring cytoskeleton dynamics. Analyst, 2016, 141, 5674-5688. doi: 10.1039/C6AN00731G
- Zhong et al. Developmental mechanism of the periodic membrane skeleton in axons. eLife 2014;3:e04581. doi: 10.7554/eLife.04581