Originalmente publicado en inglés por Arielle Mensch y Yi Cui
Publicado el 5 de Octubre del 2018
Traducio por Mariah Dooley, Editado por Curtis Green
Hace poco recibimos una pregunta muy intrigante de una lectora de 12 años, Olivia, que preguntó: «¿Cómo pueden los científicos determinar la textura de las células?» Esta es una gran pregunta y, como la mayoría de las grandes preguntas, la respuesta es un poco complicada. Los científicos tenemos una variedad de herramientas que podemos usar para medir la textura de las células, de las que explicaremos un poco en esta publicación. Pero primero, quizás te preguntes, ¿por qué nos importa la textura de una célula…?
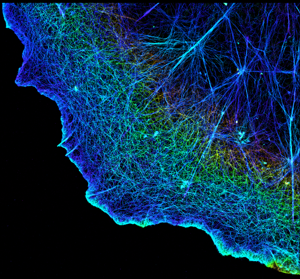
Figura 1. Imagen de ejemplo de TORMENTA del borde de una célula (reproducida de Xu et al., Nature Methods, 20121 con permiso de Springer Nature)
Bueno, mirar la textura o la topografía de una célula nos puede dar una idea de la salud de la célula. La parte más externa de la célula es su membrana, sobre lo que hemos escrito anteriormente como una barrera muy importante entre el interior y el exterior de la célula (para obtener más información, consulte nuestras publicaciones anteriores ¿Cómo entienden los científicos la membrana celular? , ¿Las nanopartículas se adhieren a las bacterias? ¿Las nanopartículas se adhieren a las bacterias? ¿O, de qué manera las membranas celulares son como el velcro?? y ¿cómo las nanopartículas entran en las células?) La membrana celular desempeña un papel crucial en la regulación de lo que entra y de lo que sale de una célula. Por ejemplo, podemos observar una membrana celular antes y después de la exposición a una nanopartícula y ver si la nanopartícula afecta la textura y la topografía de la célula. ¿Se formaron defectos u orificios, lo que sugiere que la nanopartícula dañó la membrana? ¿La célula introdujo la nanopartícula (absorción) a través de su membrana? ¿La nanopartícula se atascó en la superficie celular? Para estudiar estas preguntas sobre cómo se ve la superficie celular, necesitamos herramientas que puedan estudiar la textura de la célula.
Microscopio de fuerza atómica (AFM)
Una técnica crucial para estudiar la topografía de las células (y muchas otras superficies) se llama microscopio de fuerza atómica (AFM). Hemos descrito la técnica en detalle anteriormente aquí, pero de manera simple, AFM utiliza un soporte o viga con una punta muy pequeña (tamaño nanométrico) para trazar la topografía tridimensional de una muestra. El científico determina cuánta fuerza aplicar a la muestra (una célula en nuestro caso) y el instrumento funciona al mantener esta cantidad de fuerza establecida. A medida que la punta escanea a través de la muestra, una luz láser alineada con la punta se refleja desde la punta hacia un detector. A medida que la punta se mueve hacia arriba o hacia abajo para mantener la cantidad de fuerza establecida, el detector detecta cualquier cambio en la altura que haya sufrido la punta en función de los cambios en la altura de la luz láser. Esto nos da una medida muy sensible de la altura de una muestra. La figura 2 muestra cómo se ve esto en caricatura.
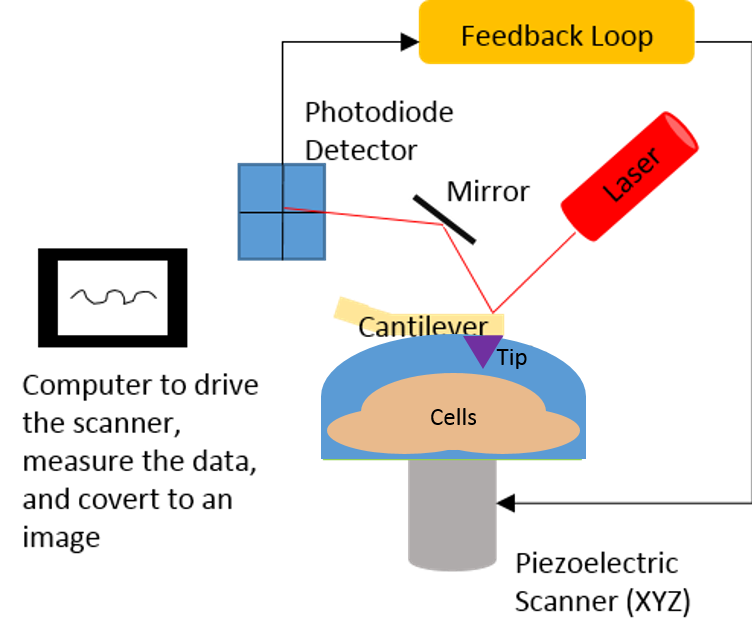
Figura 2. Esquema que muestra cómo se puede usar un AFM para medir la topografía de las células. (Imagen de Arielle Mensch)
AFM es ideal para medir muestras en diferentes entornos. Puede funcionar en aire, vacío, o incluso en líquido. La capacidad de trabajar en líquido significa que podemos estudiar la topografía en las células cuando están hidratadas, que es como se encuentran naturalmente. La Figura 3 muestra algunas de mis imágenes favoritas de AFM que he tomado de las células (estas células provienen de las branquias de una trucha).

Figura 3. Algunas de mis imágenes favoritas de AFM recolectadas en células epiteliales branquiales de trucha. (Imágenes de Arielle Mensch)
Al igual que un mapa topográfico de una cadena montañosa, una imagen de AFM muestra 3 dimensiones: las dimensiones laterales (x-y), así como la dimensión z (altura). Los diferentes colores en las imágenes corresponden a diferentes alturas. Cuanto más oscuro es el color, más baja es la altura y más claro es el color, más alta es la característica. ¡Podemos medir las diferencias en altura a nanoescala para diferentes características que se encuentran en la superficie de la célula! Si bien podemos observar diferentes características, no podemos decir químicamente cuáles son estas características (alerta de spoiler: la microscopía de fluorescencia se puede combinar con AFM para ayudarnos a conocer ambas. Más sobre esto más adelante). En lo que realmente AFM es excelente y por qué nos encanta en CSN es que puede medir cambios muy pequeños en la topografía de las células. Por ejemplo, si una nanopartícula cae en la célula o induce algún agujero o defecto en la membrana de la célula, ¡podremos ver esos cambios con AFM!
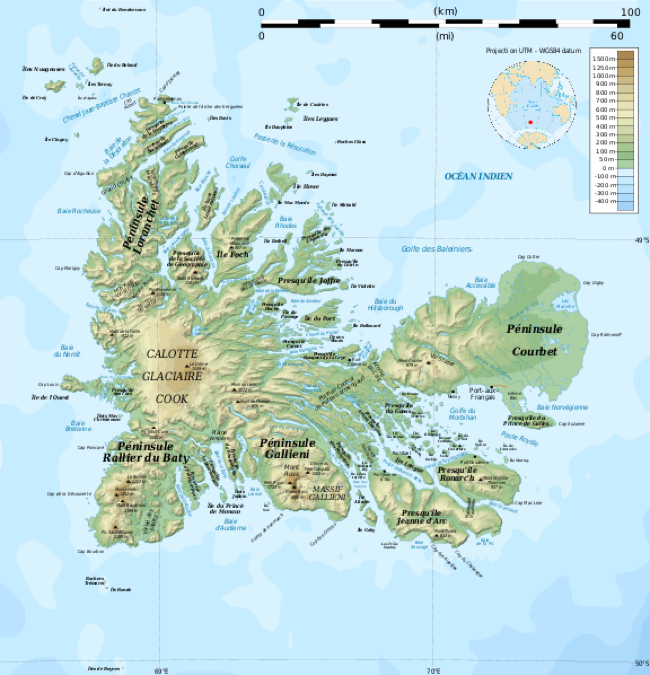
Figura 4. Un ejemplo de mapa topográfico de las Islas Kerguelen que muestra elevaciones usando color, similar a cómo una imagen de AFM muestra la altura usando sombreado. (Imagen de Rémi Kaupp)
Microscopio Electrónico de Barrido (SEM)
El Microscopio Electrónico de Barrido (SEM) es otra herramienta que puede usarse para estudiar la textura de una célula. En lugar de un rayo láser como AFM, SEM usa un rayo de electrones enfocado para generar una imagen (consulta esta publicación para obtener más información — aqui en español). Con la detección de electrones secundarios SEM, los científicos pueden obtener textura o topografía. Esta técnica funciona al escanear una muestra con un rayo de electrones, lo que hace que los electrones «secundarios» de baja energía sean expulsados de los átomos alterados en la muestra. Estos electrones se envían a un detector, que mide la cantidad de electrones provenientes de cada región en la muestra. Las áreas cercanas al detector aparecen más brillantes (más electrones secundarios alcanzan el detector), mientras que las áreas más alejadas aparecen más oscuras (menos electrones llegan al detector). Este contraste en la densidad de electrones da lugar a una imagen de la textura de una muestra. En la Figura 5 se puede ver un ejemplo de visualización de células sanguíneas utilizando un SEM.
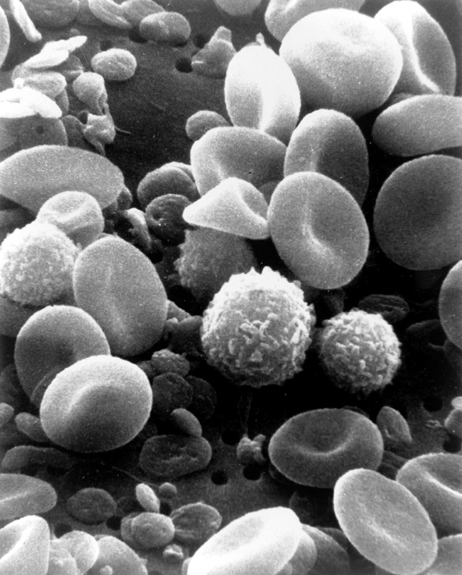
Figura 5. Imagen con SEM de células sanguíneas. (Imagen de Bruce Wetzel y Harry Schaefer, Instituto Nacional del Cáncer)
SEM generalmente se basa en un entorno vacío para generar una imagen. El uso de un rayo de electrones en un entorno con muchas moléculas de gas flotando alrededor (como el aire) se propagaría rápidamente y debilitaría el rayo de electrones, ya que los electrones del rayo rebotarían en esas moléculas de gas. Además, la muestra para SEM debe ser conductora. Una muestra no conductora acumulará una carga de electrones cuando el rayo escanee sobre él y disminuirá considerablemente el enfoque y la resolución de la imagen. Por lo tanto, para obtener imágenes de las células bajo el alto vacío requerido para SEM, primero se deben secar y recubrir con un material conductor (como el oro o el carbono; mira este acercamiento de una mariquita para ver un ejemplo). Este método saca una célula de su entorno líquido natural y puede terminar distorsionando la topografía real de la célula natural. Sin embargo, los científicos están trabajando de manera que se pueda superar esto. Algunas opciones incluyen:
- Cryo-SEM, donde el SEM es operado a una temperatura muy baja y las células se conservan mediante una forma especial de congelación. Este método permite que la célula permanezca hidratada, pero aun así requiere que la muestra esté cubierta con un metal para que sea conductora.
- SEM ambiental (ESEM), que permite obtener imágenes de muestras húmedas y / o no recubiertas (no se requiere recubrimiento conductor).
- El uso de cápsulas especiales que sellan las células en líquido y no son perturbados por el vacío.2,3
Microscopio fluorescente
Cuando se trata de determinar el paisaje topográfico de la superficie de una célula, AFM y SEM realmente son excelentes al proporcionarnos impresionantes detalles inaccesibles con los medios tradicionales. Sin embargo, como el pilar del campo de la imagen, el microscopio fluorescente también sirve como una herramienta útil para sondear la textura de las células, directamente o indirectamente. Un microscopio fluorescente utiliza materiales que pueden absorber y emitir luz en determinados rangos, y recopila esta luz emitida para generar una imagen (consulta esta publicación para obtener más información sobre la fluorescencia).
Un beneficio del uso del microscopio fluorescente es su capacidad para obtener imágenes específicas del objetivo, que es más difícil para AFM o SEM. Las imágenes específicas del objetivo significan que podemos marcar específicamente una molécula de interés dentro de la célula y usar sondas fluorescentes para hacer que esa molécula se vea brillante cuando la alteremos con un láser. Después de ver una variedad de características de la membrana celular como lo revelan AFM y SEM, es posible que deseamos profundizar y descubrir de qué están hechas esas estructuras y cómo influyen en las funciones de la célula. Las imágenes específicas del objetivo pueden responder estas preguntas. Al usar moléculas específicas que se unen a la característica de interés, las imágenes de fluorescencia pueden visualizar la distribución y los patrones de localización de componentes celulares específicos, como los receptores de membrana y los componentes del citoesqueleto (consulte las fotos del citoesqueleto para obtener más información).
Desde que los científicos comenzaron a utilizar técnicas de fluorescencia de súper resolución en 2006, la microscopía de fluorescencia está alcanzando rápidamente la resolución de imagen de AFM y, por lo tanto, puede responder muchas preguntas sobre por qué una célula parece ser la misma. Por ejemplo, como se muestra en la Figura 6, el citoesqueleto de una célula está marcado con un anticuerpo específico para tubulina (la tubulina es una proteína que se encuentra en el citoesqueleto). La técnica de fluorescencia de súper resolución llamada STORM puede aumentar la resolución de la imagen a aproximadamente 10 nm (una mejora> 20 veces mayor que los métodos convencionales de microscopía óptica), lo que puede mejorar considerablemente nuestra comprensión de la forma y el movimiento de las células. ¡Un hecho más alentador es que ahora es posible combinar microscopía de fluorescencia de súper resolución y AFM! (Figura 7)4 Por lo tanto, los científicos no solo pueden determinar cómo se ve la superficie de una célula, sino que también pueden aprender cuáles son los componentes subyacentes.

Figura 6. El citoesqueleto interior se puede visualizar usando la técnica de súper resolución llamada STORM. (Reproducido de Xu et al., Nature Methods, 20121 con permiso de Springer Nature)

Figura 7. Microscopía de fluorescencia correlacionada y AFM. (Reproducido de Hecht et al., Analytical Chemistry, 20124, con permiso de la Sociedad Americana de Química)
Microscopía de luz de celosía
Pero espera, la microscopía de fluorescencia quiere aportar más. ¿Objetivo específico? ¿Súper resolución? ¿Tridimensional? ¿Célula viva? ¡Hey, hagámoslos todos a la misma vez! Como sabemos, cada célula es un sistema vivo y, por lo tanto, altamente dinámico. Así es su textura y forma superficial. Normalmente, las actividades celulares se realizan en los niveles de milisegundos a segundos, que a menudo es demasiado rápido para que AFM y SEM puedan mantenerse al día. La última técnica de microscopía de fluorescencia de gama alta, llamada microscopía de luz de celosía (desarrollada por el laureado Nobel Dr. Eric Betzig5), proporciona otra herramienta innovadora para que los científicos investiguen células individuales vivas con resoluciones sin precedentes. Con este avance técnico, por primera vez, los científicos tienen la capacidad de capturar claramente las actividades relacionadas con las membranas celulares, como el movimiento de movimiento rápido de filopodios (Película 1), el rastreo de células (Película 2) y el contacto dinámico entre células (Película 3). Dicho esto, la odisea científica de revisar la biología celular apenas comienza a medida que más laboratorios están adoptando nuevas plataformas y métodos para estudiar las células.
Película 1. Movimiento de rápida rotación de los filopodios en la superficie de una célula HeLa (los filopodios son pequeñas proyecciones de membrana que facilitan que las células detecten, migren e interactúen). (Película de Betzig Lab, HHMI / Janelia Research Campus; número 24/10/14 de la revista Science)
Película 2. Dinámica de membrana de una célula de neutrófilos HL-60 que migra sobre un vidrio. (Película de Betzig Lab, HHMI / Janelia Research Campus, Mullins Lab, HHMI / Universidad de California, San Francisco; publicado 24/10/14 en la revista Science)
Película 3. Interacción de membrana de una célula inmunitaria (roja) que detecta y ataca a una célula potencialmente patógena (azul). (Película de Betzig Lab, HHMI / Janelia Research Campus, Lippincott-Schwartz Lab, Institutos Nacionales de la Salud; publicado 24/10/14 en la revista Science)
En cuanto a la obtención de imágenes de las células para determinar su textura, cada una de las tres técnicas que hemos descrito tiene sus propios desafíos con la preparación de la muestra. Para el AFM, es crucial minimizar la fuerza aplicada a la célula para garantizar que la punta de escaneo no dañe las células. Además, las células deben estar fuertemente pegadas al sustrato. De lo contrario, es posible arrastrar la celda con la punta, lo que definitivamente me ha pasado en más de una ocasión. Para SEM, la necesidad de trabajar bajo el vacío en la mayoría de los casos requiere secado o congelación y luego recubrimiento de la muestra con un material conductor. Esto puede afectar la textura de la superficie. La microscopía de fluorescencia requiere pasos de coloración adicionales para etiquetar los objetivos de interés en las células fijas, lo que depende en gran medida de que haya una coloración de alta calidad para su objetivo disponible. Para la obtención de imágenes de fluorescencia de células vivas, la forma predominante es mediante la introducción de una versión fluorescente de proteínas objetivo, que requiere un tratamiento especial de las células antes de la obtención de imágenes.

Tabla 1. Comparación de las tres técnicas discutidas aquí. Esta información se basa en nuestras experiencias en el CSN.
Entonces, ¿cuál de las tres técnicas analizadas es la mejor técnica para determinar la textura de una célula? Bueno, las tres técnicas tienen sus ventajas y desventajas, como se muestra en la Tabla 1. En términos de determinar qué técnica usar para aprender la textura de la célula, ¡realmente depende de la pregunta que intenta responder y la instrumentación disponible! Los científicos de todo el mundo están trabajando arduamente usando las tres técnicas (a veces en combinación) para aprender sobre la textura de las células.
REFERENCIAS (en inglés)
- Xu, K., Babcock, H., & Zhuang, X. Dual-objective STORM reveals three-dimensional filament organization in the actin cytoskeleton. Nature Methods, 2012. 9:2. Doi: 1038/nmeth.1841
- QuantomiX: http://www.wetsem.com/
- Thiberge, S., Nechushtan, A., Sprinzak, D., Gileadi, O., Behar, V., Zik, O., . . . Kornberg, R. Scanning Electron Microscopy of Cells and Tissues under Fully Hydrated Conditions. Proceedings of the National Academy of Sciences of the United States of America, 2004,101(10), 3346-3351. https://www-jstor-org.ezp2.lib.umn.edu/stable/3371481
- Hecht, E., Thompson,K., Frick, M., Wittekindt, O., Dietl, P., Mizaikoff, B., & Kranz. C.Combined Atomic Force Microscopy–Fluorescence Microscopy: Analyzing Exocytosis in Alveolar Type II Cells. Analytical Chemistry 2012 84 (13), 5716-5722. DOI: 1021/ac300775j
- NobelPrize.org. Eric Betzig Facts. Retrieved from https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2014/betzig-facts.html